- 029-86354885
- 18392009562

內容提要
**的精確治療越來越受到重視。γ-谷氨酰轉肽酶(GGT)是**中顯著上調表達的生物標志物。作者開發了一種GGT響應的近紅外(NIR)納米粒子,用于**特異性熒光成像引導的光熱治療。GGT響應性近紅外探針NRh-G自發聚集成納米粒子NRh-G-NPs。該納米粒子經與GGT特異反應熒光增強約180倍,并表現出良好的光熱效應。在激光照射下,NRh-G-NPs可以選擇性地照亮U87MG**細胞并進行消融。在荷瘤小鼠體內靜脈注射NRh-G-NPs后,NRh-G-NPs可以到達**區域并特異地照亮**,對U87MG**中過表達的GGT有特異性反應,選擇性地照亮**進行成像引導治療。在激光照射后,**可完全清除,40天內無**復發。
前言
癌癥對人類健康和生命構成重大威脅。除手術、放療、化療等多種癌癥治療方法外,光熱療法(PTT)近年來因其高療效和特異性而備受關注。在光熱轉換劑的幫助下,光照射被吸收并轉化為熱量,以最小的副作用破壞癌組織。理想的光熱轉化劑應該是無毒的,具有高**靶向性和高效的光熱轉化能力。自成像能力是識別光熱劑積累的首選更好地指導激光手術窗口和劑量。在各種光熱制劑中,有機染料因其排泄快、生物相容性好、臨床轉化能力強而備受關注。基于花菁和二酮吡咯的有機染料在近紅外(NIR)光激發下具有更高的穿透深度,因此代表了**治療領域的研究熱點。近年來,智能納米系統的診斷和治療功能可以通過**微環境(如pH、缺氧、酶)或外部刺激(如光、超聲、磁)在**區域選擇性激活,具有更高的治療選擇性和效率。本研究通過響應GGT的近紅外花菁熒光團(NRh-G)在水中自發聚集成納米粒子NRh-G-NPs,在正常生理環境下保持OFF狀態,而在過表達GGT的**細胞中NRh-G-NPs上的γ-Glu部分被特異性識別并被切斷開啟了熒光和光熱能力,從而最大限度地提高了治療的特異性和準確性。
結果與討論
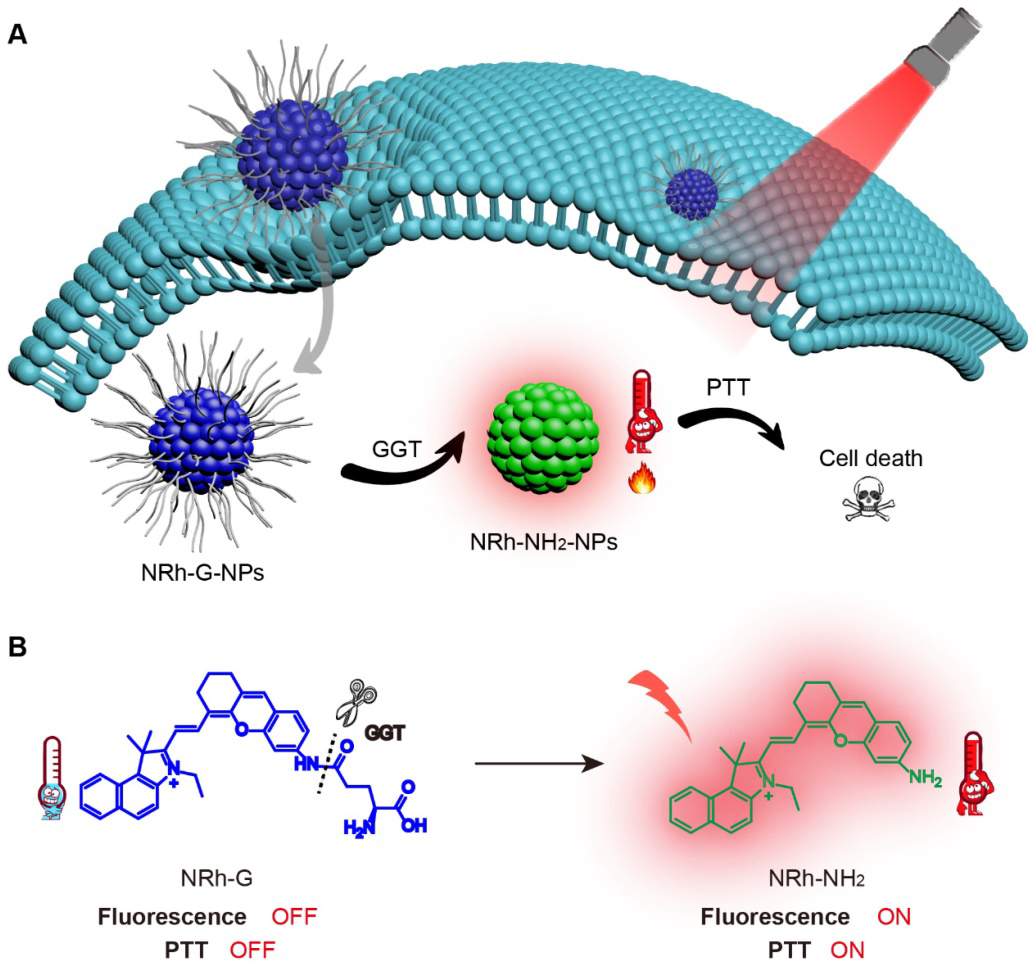
NRh-G的結構由GGT特異性底物γ-Glu和近紅外花菁熒光團NRh-NH2組成。氨基酸γ-Glu作為GGT識別底物被廣泛應用,可被GGT特異性識別和切割。NRh- NH2在740 nm處具有較強的熒光,隨后與Boc-Glu-OtBu反應生成中間產物NRh-G-Boc,通過Boc脫保護反應生成最終產物NRh-G(圖1A)。NRh-G-NPs進入GGT高表達環境后,γ-Glu部分被特異性識別并裂解。將NRh-G-NPs轉化為NRh-NH2-NPs,在714 nm處有近紅外吸收峰,在740 nm處有熒光恢復(圖1B)。TEM圖像顯示單分散的NRh-G-NPs,尺寸約為50 nm(圖1C)。經GGT處理后,NRh-NH2-NPs的大小減小到20-30 nm。DLS測量的水動力學尺寸從90 nm (圖1D)降至70 nm,Zeta電位也從-0.3 mV(圖1D)改變到6.0 mV。用GGT處理30分鐘,在714 nm處出現紫外吸收峰(圖1E)。隨著孵育時間(0 ~ 30 min,圖1F)和GGT濃度(0 ~ 1.0 U/L,圖1G)的增加,740 nm處的熒光發射逐漸增加。
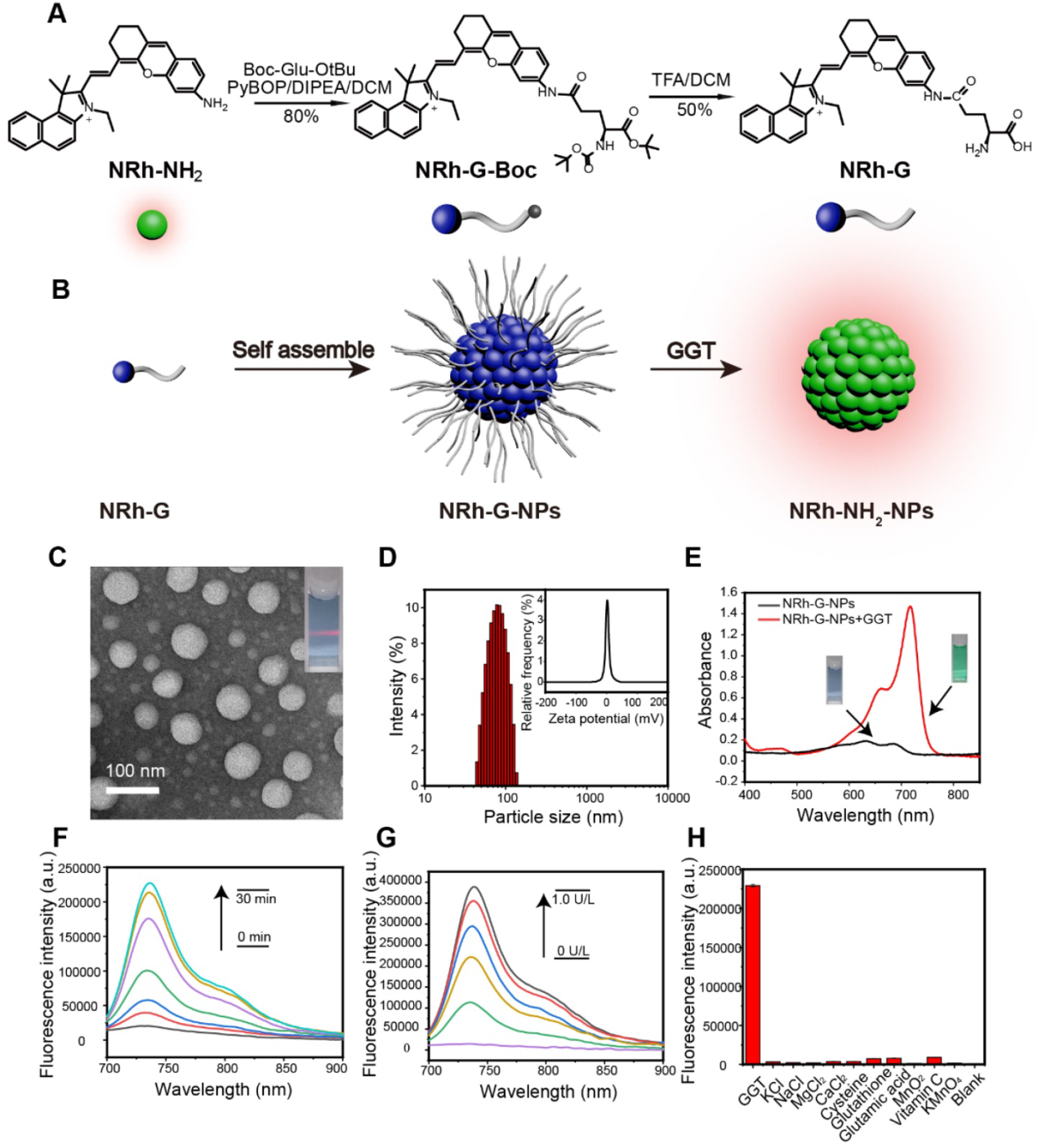
圖1。(A) NRh-G的化學結構和合成步驟。(B) NRh-G自組裝形成NRh-G-NPs,然后被GGT切割形成NRh-NH2-NPs發出熒光。(C)納米粒子的TEM圖像。(D)通過動態光散射(DLS)測量的納米顆粒的水合粒徑和zeta電位。(E) NRh-G-NPs (5.8 μg/mL)與GGT (0.4 U/L)反應前后溶液的紫外吸收光譜。(F) GGT (0.4 U/L) 0 ~ 30 min, NRh-G-NPs (5.8 μg/mL)的熒光光譜變化。(G)不同濃度的GGT (0 ~ 1.0 U/L)孵育30 min后,NRh-G-NPs(5.8 μG /mL)的熒光光譜變化。(H) NRh-G-NPs (5.8 μg/mL)對GGT (0.4 U/L)以及其它干擾物種 (0.5 mM)的熒光強度。
NRh-G-NPs在U87MG細胞中的細胞毒性表明,不同濃度的NRh-G-NPs在0 ~ 57.6 μg/mL范圍內的細胞存活率均超過90%,表明NRh-G-NPs適合用于活細胞成像。用NRh-G-NPs檢測活細胞中GGT的活性。首先,在NRh- G-NPs作用下,U87MG細胞的熒光隨時間逐漸增強,在20分鐘左右達到穩定值(圖2A)。作者用特定的GGT抑制劑(azaserine)對U87MG細胞進行預處理,然后與NRh-G-NPs (5.8 μg/mL)孵育20分鐘,經抑制劑預處理的細胞的熒光信號明顯下降(圖2B)。當高酶表達的U87MG細胞與NRh-G-NPs孵育20 min時,觀察到強烈的熒光信號。而相同時間的NRh-G-NPs處理低酶表達L02細胞顯示出較弱的熒光。當L02細胞用GGT促進劑預處理,然后與NRh-G-NPs共孵育20分鐘時,觀察到熒光信號增強(圖2C)[59]。因此,NRh-G-NPs可以區分正常細胞和癌細胞,而且確實具有GGT特異性。由于GGT是氧化應激的早期敏感標記物,作者研究了GGT與潛在的抗癌藥物NaBu協同誘導細胞氧化應激的作用。預處理細胞中NaBu濃度越高,與NRh-G-NPs孵育后的熒光強度越強。同時,高濃度NaBu預處理后死細胞比例顯著增加。因此,抗癌藥物NaBu和NRh-G-NPs可以同時用于癌癥的診斷和治療。
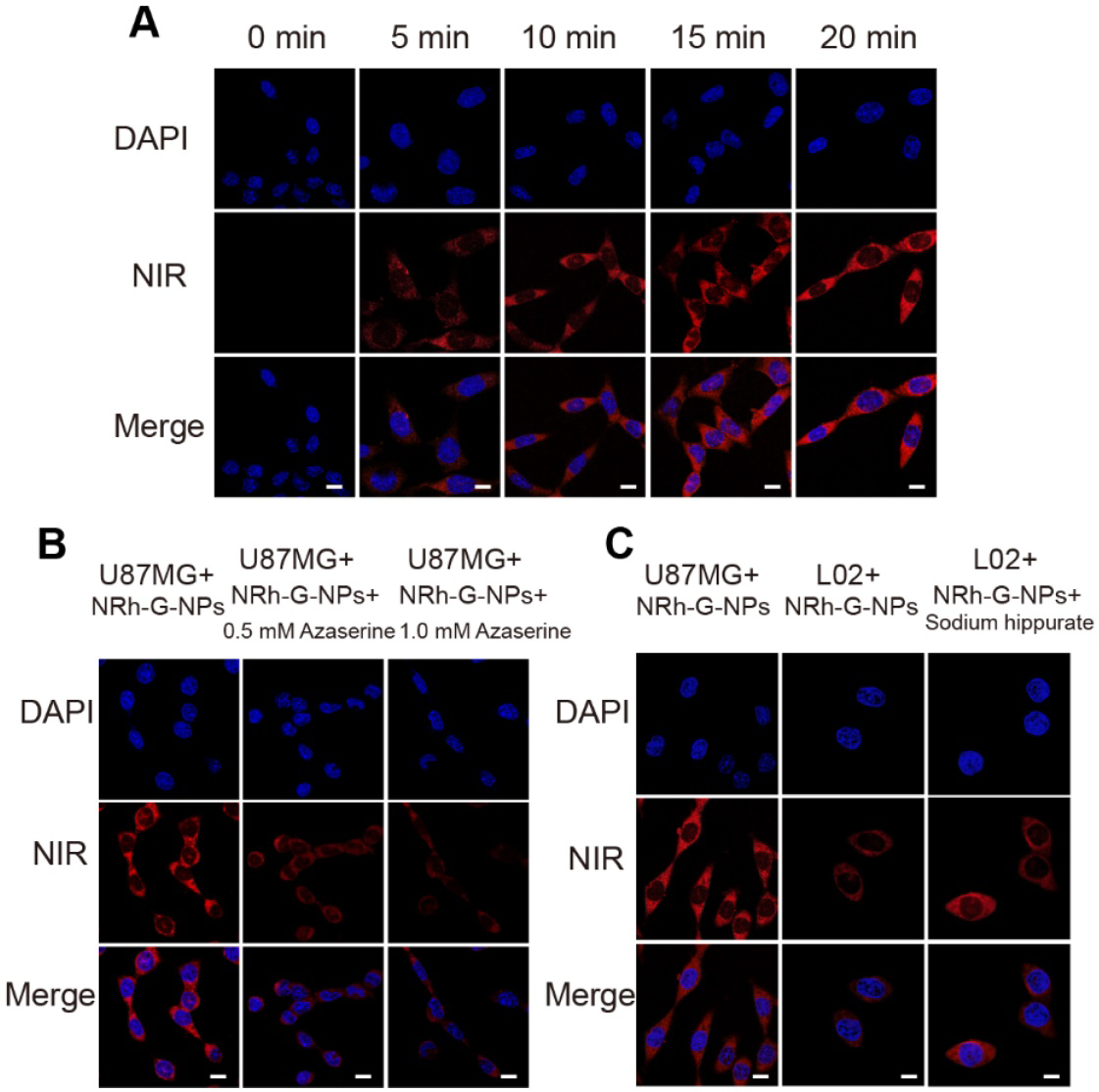
圖2。(A) NRh-G-NPs(5.8μg/mL)孵育0、5、10、15、20分鐘U87MG細胞的熒光共聚焦圖像。(B) NRh-G-NPs(5.8μg/mL)孵育U87MG細胞的熒光共聚焦圖像;NRh-G-NPs(5.8μg/mL)孵育GGT抑制劑預處理的U87MG細胞的共聚焦熒光圖像。(C) NRh-G-NPs(5.8μg/mL)孵育U87MG細胞和L02細胞的共聚焦熒光圖像;NRh-G-NPs (5.8μg/mL)孵育的GGT促進劑預處理(1.0 mM) L02細胞共聚焦熒光圖像。比例尺:10 μm。
通過尾靜脈將納米顆粒注射到U87MG荷瘤裸鼠體內,評價NRh-G-NPs對體內**的被動靶向能力。采用生物發光成像系統監測全身熒光。從圖3A可以看出,在注射NRh-G-NPs的小鼠**中,熒光逐漸增加,在1.5 h時熒光最強,隨后在注射5h后熒光開始減弱并完全消失。定量分析顯示,注射NRh-G-NPs的小鼠的信噪比(SNR)在1.5 h內顯著上升,然后開始下降。注射NRh-G-NP 1.5 h后解剖小鼠,切除心臟、脾臟、**、肺、腸、腎、肝進行生物成像。與其他器官相比,**的熒光非常強。切片**組織后也進行共聚焦成像(圖3C)。對深度為35 μm的U87MG**組織切片進行三維重建。結果表明,NRh-G-NPs通過被動靶向**定位,可用于**中GGT的有效實時無創成像。
圖3。(A)通過尾靜脈注射NRh-G-NPs (2.9 mg/mL)后小鼠的實時熒光圖像。(B)小鼠尾靜脈注射NRh-G-NPs 1.5 h后,從U87MG荷瘤小鼠中切除的心臟(1)、脾臟(2)、**(3)、肺(4)、腸(5)、腎(6)和肝(7)的熒光圖像。(C) U87MG**組織切片深度在35μm之間的共聚焦z掃描成像切片。標尺: 100μm。
當GGT特異性切斷NRh-G-NPs的氨基酸鏈時,產物NRh-NH2-NPs在730 nm激光照射下表現出光熱效應和730 nm激光照射下的光熱效應(圖4A)。不同濃度的NRh-G-NPs加入或不加入1.0 U/L酶孵育20 min,然后在730 nm (1.0 W/cm2)激光照射下孵育5min。激光照射下,未加GGT處理的不同濃度NRh-G-NPs的溫度沒有明顯變化(圖4B)。而在相同激光照射條件下,酶培養后的升溫速度和最終達到的溫度與NRh-G-NPs的濃度成正比(圖4C)。圖4B和圖4C中的NRh-G-NPs (34.6 μg/mL)在730 nm激光照射5分鐘后的紅外熱像圖如圖4D,同時也證實了NRh-NH2-NPs具有良好的光熱穩定性。不同濃度的NRh-NH2在730 nm激光照射5分鐘,通過監測了溫度的變化,NRh-G-NPs與GGT的反應產物具有優良的光熱性能。
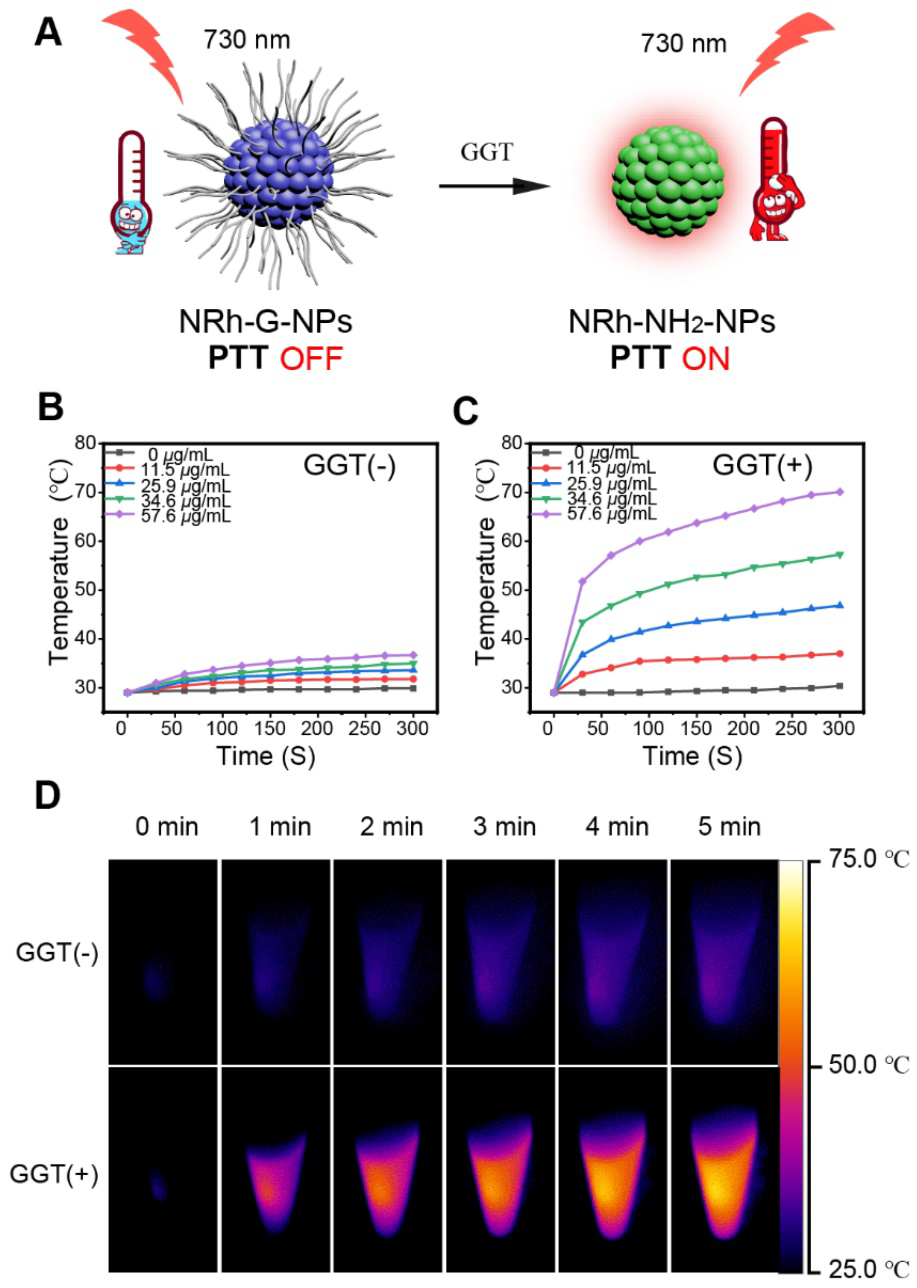
圖4。(A)光熱特性開啟示意圖。(B)不同濃度NRh-G-NPs(0、11.5、25.9、34.6、57.6 μg/mL)在730 nm (1.0 W/cm2)光照5分鐘后的溫度曲線。(D)無GGT孵育和有GGT孵育的NRh-G-NPs (34.6 μg/mL)的紅外熱像圖。
NRh-G-NPs對U87MG癌細胞無明顯的細胞毒性,即使在高達57.6 μg/mL的蛋白濃度下也無明顯的細胞毒性,作者使用730 nm激光照射不同濃度的NRh-G- NPs孵育的細胞。隨著NRh-G-NPs濃度的增加,細胞存活率顯著降低(圖5A)。激光照射后NRh-G-NPs孵育細胞的死亡率較高,GGT抑制劑預孵育后細胞死亡率下降(圖5B, 5C)。因此,鈣黃素和碘化丙啶共染色細胞的MTT檢測和倒置熒光成像進一步證實了NRh-G-NPs對U87MG細胞的有效和特異性光熱消融作用,在特定條件下能體外殺傷**細胞。
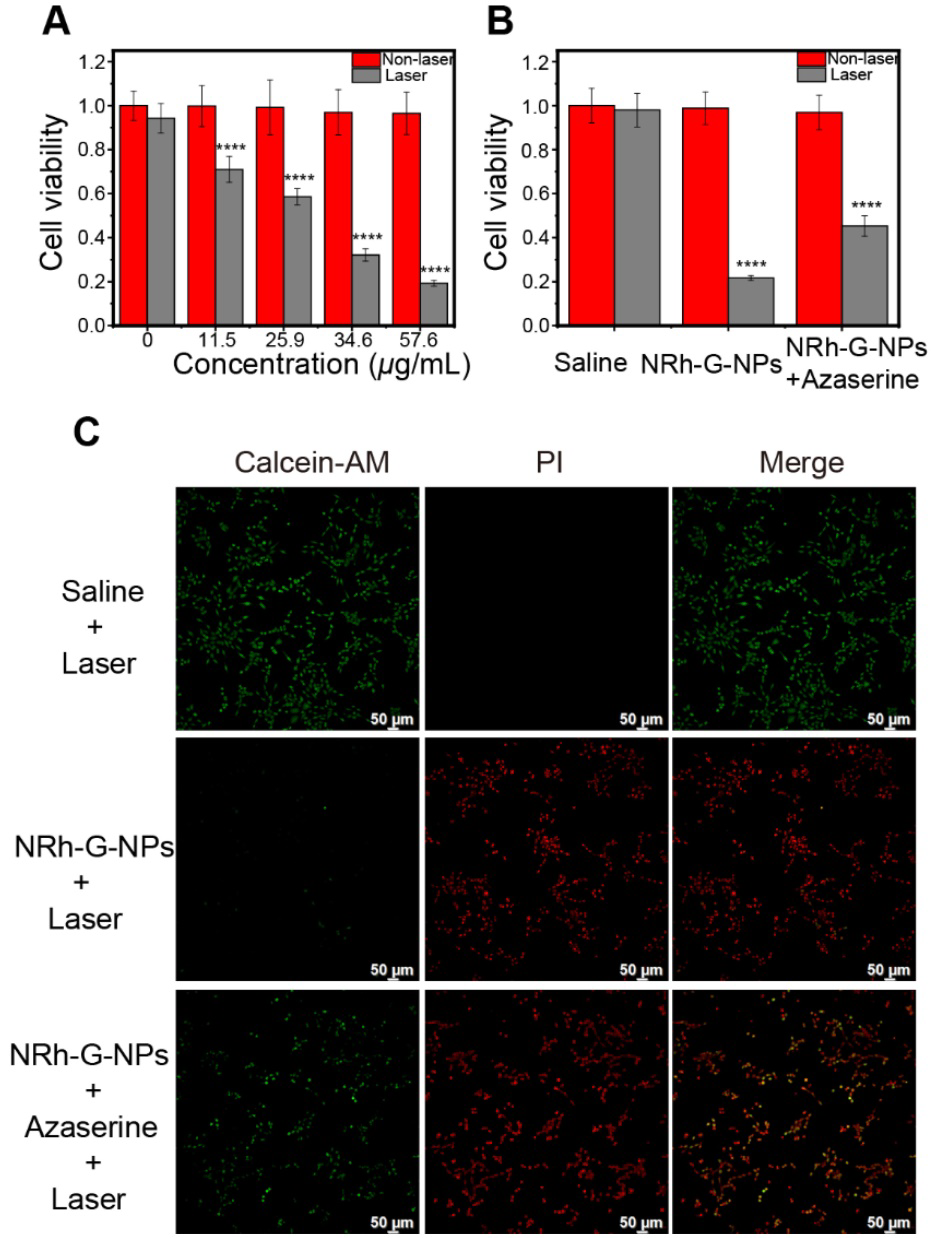
圖5。(A)在730 nm激光(1.0 W/cm2)照射下,不同濃度的NRh-G-NPs誘導U87MG細胞的相對存活率。(B)不同孵育條件下隨730 nm激光(1.0 W/cm2)孵育U87MG細胞的細胞毒性。(C) 不同孵育條件下U87MG細胞,經鈣綠素AM/PI染色后,置于730 nm激光(1.0 W/cm2)照射前的倒置熒光圖像。
基于NRh-G-NPs在體內對**的被動靶向及其強近紅外吸收,我們在小鼠U87MG細胞皮下**模型上進行了體內光熱治療的研究(圖6A)。采用紅外熱像儀每隔1 min直接監測小鼠體溫。在靜脈注射NRh-G- NPs或生理鹽水1.5 h后,小鼠暴露于730采用紅外熱像儀監測溫度(圖6B)。注射NRh-G-NPs的小鼠,在激光照射下**表面溫度從36°C迅速上升到54°C。在相同的照射條件下,其他各組小鼠的**溫度沒有明顯變化(圖6D)。H&E染色的**切片組織學檢查顯示,在激光照射后,只有NRh-G-NPs注射組的**結構嚴重受損(圖6C)。治療組(NRh-G-NPs +激光)小鼠**經過2天的光熱治療完全消融,觀察期間未見**再生。注射生理鹽水或NRh-G-NPs,或僅注射相同功率的激光照射對**生長沒有影響(圖6E)。治療后1天解剖**的照片顯示, NRh-G-NPs + Laser組**明顯縮小,而其他三組**體積增大。治療14 d后,4組小鼠均處死,切取主要臟器進行H&E染色。結果顯示,器官沒有受到任何明顯的損傷。四組小鼠的體重也沒有異常變化(圖6F)。與3個對照組的平均壽命相比,經過NRh-G-NPs誘導的光熱治療的小鼠存活超過40天(圖6G)。NRh-G-NPs可以在動物模型中有效、準確地治療**而不損傷其他器官。
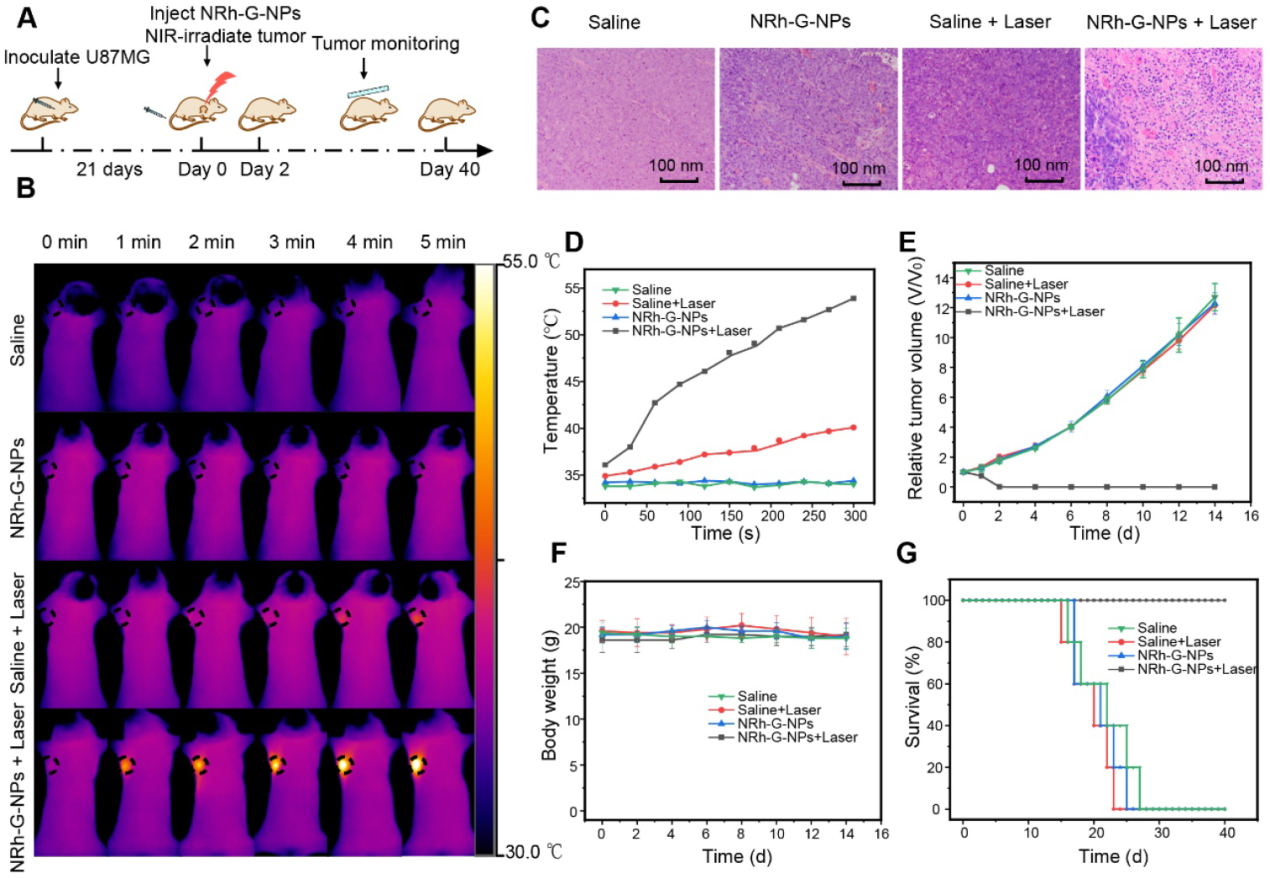
圖6。(A)光熱治療流程圖。(B) U87MG荷瘤小鼠靜脈注射生理鹽水或NRh-G-NPs (2.9 mg/mL)的紅外熱像圖;對U87MG荷瘤小鼠在730 nm激光(1.0 W/cm2)照射下靜脈注射生理鹽水或NRh-G-NPs (2.9 mg/mL)的紅外熱像圖。(C) H&E染色治療組和其他三個對照組的**切片。(D)根據(B)中紅外熱像數據得出的**溫度變化。(E)不同治療組小鼠的**生長曲線。(F)各組小鼠體重。(G)不同治療組小鼠的存活率。
結論
作者合成了一種能特異性檢測和治療惡性**的γ-谷氨酰轉肽酶激活的近紅外納米粒子NRh-G-NPs,在血液循環過程中不表現出熒光或光熱效果。EPR效應導致**高聚集,被**部位高表達的酶GGT激活,生成的NRh-NH2-NPs顯示出強大的熒光發射,可用于**診斷,并在光熱治療中顯示出優異的光熱轉換特性。體內和體外實驗均證明了NRh-G-NPs對**治療的特異性和有效性,在熒光成像引導的光熱治療中具有巨大的潛力。
參考文獻
Fangyuan Zhou, Shikui Yang, Chao Zhao, Wangwang Liu, Xufeng Yao, Hui Yu, Xiaolian Sun*, Yi Liu*, Theranostics, 2021, 11, 7045-7056. DOI: 10.7150/thno.60586. https://www.thno.org/v11p7045.html.
產品提供
| 序號 | 新聞標題 | 瀏覽次數 | 作者 | 發布時間 |
|---|---|---|---|---|
| 1 | 瑞禧定制-功能化1,2,4,5-四嗪Cis-[Pt-1,3-Propanediamine]-2-Me-Tetrazine/IC-MethylTetrazine | 716 | 瑞禧生物 | 2022-11-09 |
| 2 | 科研-四嗪Py-Tetrazine-PEG1-Alkyne/Py-PEG1-Alkyne/Pyrimidine-Tetrazine-PEG1-Alkyne | 737 | 瑞禧生物 | 2022-11-09 |
| 3 | 胺基與NHS活性酯反應PEG之Azido-PEG7-amine/1333154-77-0瑞禧生物 | 1475 | 瑞禧生物 | 2023-01-03 |
| 4 | 瑞禧2023更新 Azido-PEG8-acid疊氮八聚乙二醇羧酸 | 640 | 瑞禧生物 | 2023-01-03 |
| 5 | 嵌段共聚物4 arm-PEG-TK-NH2 /NHS/MAL | 728 | 瑞禧生物 | 2022-12-08 |
| 6 | 活性氧敏感聚合物TK-PPE 酮縮硫醇-聚磷酸酯 PPE-TK | 773 | 瑞禧生物 | 2022-12-08 |
| 7 | 功能化腙鍵響應性磷脂 DSPE-Hyd-PEG-Alkyne/CHO/cRGD 醛基/多肽 | 771 | 瑞禧生物 | 2022-12-08 |


 400-115-0588
400-115-0588 在線咨詢
在線咨詢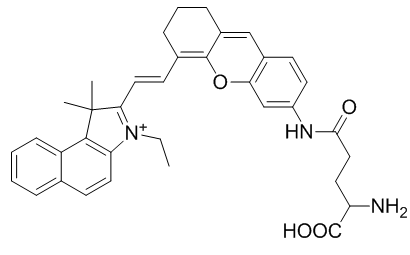








 庫存查詢
庫存查詢