- 029-86354885
- 18392009562

內容提要
通過將NO結合的Fe?S團簇摻入脫鐵蛋白腔體,構建了具有高負載效率的光活性NO釋放系統。該系統保持了完整的核-殼結構,顯示具有強的穩定性、降低細胞毒性、高效的細胞攝取和光控NO釋放等優點。
前言
NO作為第一個被發現的氣體信號分子,已被證實參與神經傳遞、心血管活動和免疫系統。NO在疾病過程中的積極和消極作用,如**生長或抑制,與NO的產生水平和細胞敏感性密切相關。通過外源性NO作為治療藥物遞送到活的惡性細胞,可以干擾NO介導的信號轉導或**進展和轉移的病理途徑。但是,外源NO的治療效果受其半衰期短和對生物物質的易變性的限制,這個問題傳統是通過NO供體來解決,如壬酸鹽和s-亞硝基硫醇衍生物,這些供體在生理條件下不穩定,釋放氣態NO。為了滿足空間和時間控制NO釋放的關鍵要求,光活性NO供體可以利用光作為受控激活的觸發器。天然脫鐵蛋白因其可逆重組特性和對過表達轉鐵蛋白受體的**細胞的特異性結合親和力而獨特,直徑約為8 nm的大空腔允許客體分子大量聚集,已經成為藥物傳遞、細胞成像、納米反應器的理想平臺。本論文將脫鐵蛋白與路森黑鹽(RBS)耦合,構建一個多重NO結合的鐵-硫簇/蛋白質復合物,在不需要內表面工程的情況下提高負載能力,光控NO釋放,高NO供應水平,Fe-NO解離后細胞毒性鐵離子的保留,促進細胞內內化。
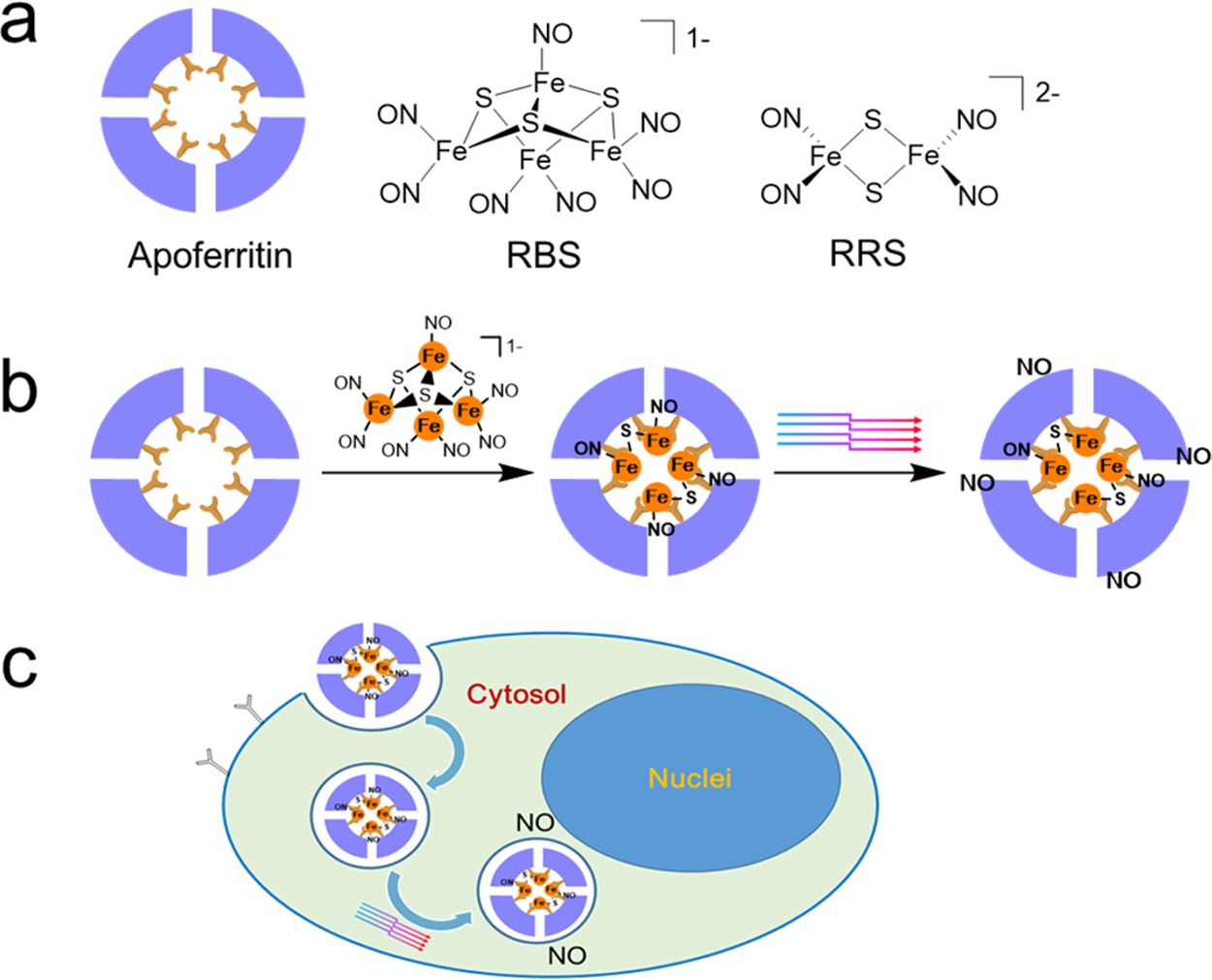
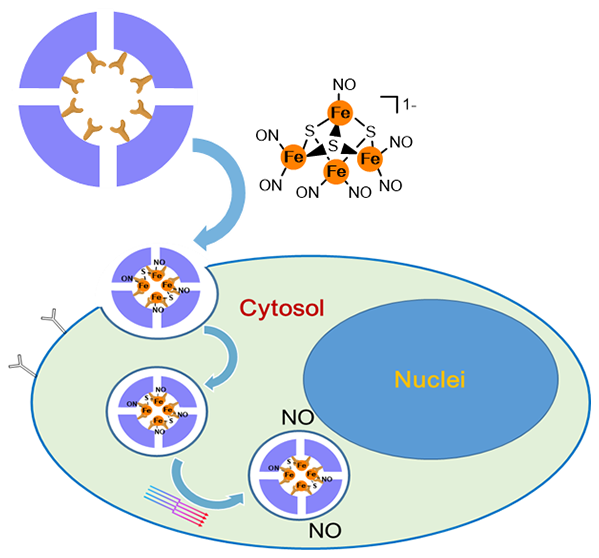
圖1. (a)脫鐵蛋白及其RBS和RRS化學結構示意圖;(b) RBS嵌入和光誘導NO釋放的說明;(c)RBS/蛋白復合材料胞內內化和光誘導胞內NO釋放的示意圖。
在pH恒定為7.4的10%乙腈/PBS緩沖液中,以鐵原子與蛋白質的摩爾比為500:1,將RBS負載到脫鐵蛋白中。用10%乙腈/PBS透析,再用PD-10柱純化,得到一個棕色的RBS-蛋白復合物(RBS-NP)溶液。通過KMnO4氧化法和電感耦合等離子體發射光譜(ICP-OES)分析,估計每個蛋白質的Fe負載量分別為213和201個原子。以醋酸鈾酰為陰性染色劑,通過HR-TEM證實了RBS-NP完整的結構,與脫鐵蛋白相似,顯示透明的外殼和致密的核被醋酸鈾酰染色(圖2a)。非染色的HR-TEM,RBS-NPs可見為與蛋白腔大小相當的斑點(圖2a)。在籠內大量積累了RBS,可能是由于Fe - S簇與組氨酸、精氨酸和色氨酸等氨基酸殘基的相互作用以及籠內疏水環境。RBS-NPs的平均水合直徑略大于脫鐵蛋白(12.9±2.6 nm vs 10.0±0.9 nm)。如圖2c所示,圓二色(CD)光譜中193 nm處的正峰和208、222 nm處的負峰均為常數(圖2c),說明RBS摻入過程確保了蛋白殼的α-螺旋和β片保持在原始狀態。
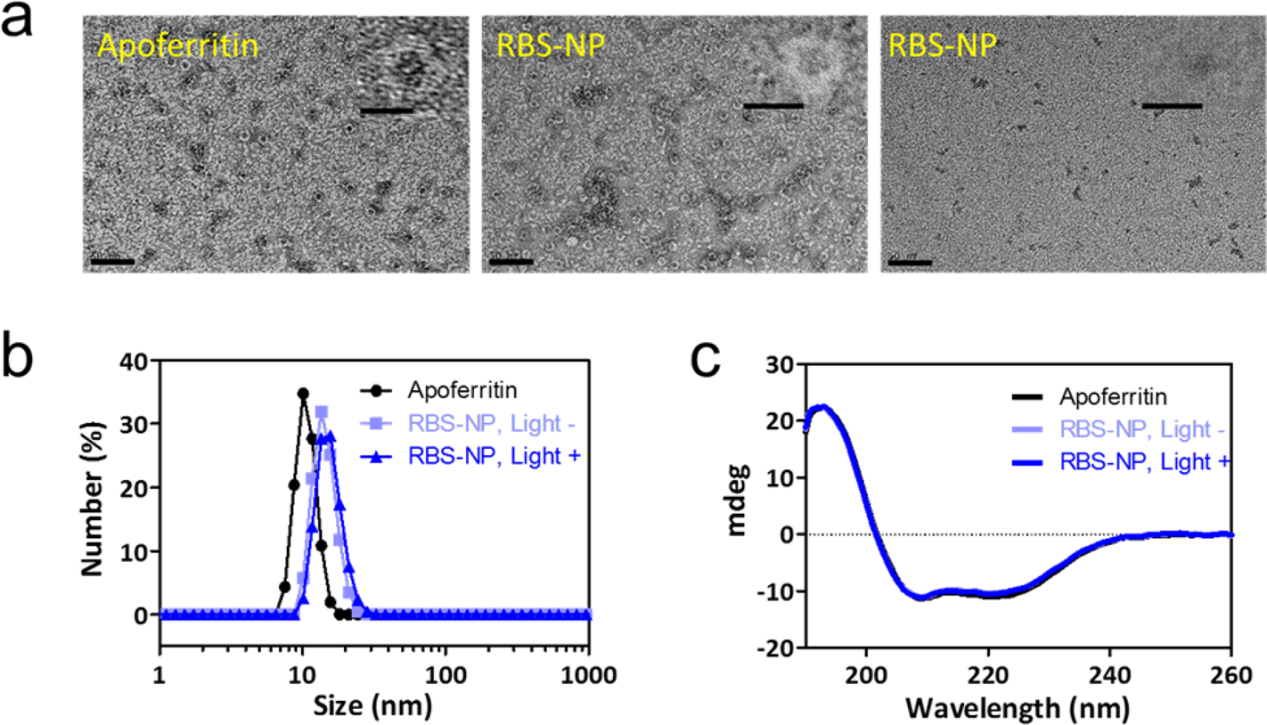
圖2. (a) 醋酸鈾酰染色的脫鐵蛋白和RBS-NP,以及未染色的RBS-NP的HR-TEM圖像(標尺為50 nm,內徑為10 nm);(b)脫鐵蛋白、RBS-NP和光處理RBS-NP的DLS分析;(c)脫鐵蛋白、RBS-NP和光處理RBS-NP的CD光譜。
白光LED照射(12 mW/cm2, 60 min)使NO完全釋放后,RBS在320 ~ 500 nm范圍內的吸收帶在PBS (pH 7.4)中消失。光照射引起了RBS-NP的吸收光譜相同的變化,這表明Fe?NO鍵被摻入過程打斷,并保持了光活性(圖3a)。RBS和RBS-NP的NO積累呈線性時間依賴性,其穩定速率分別為4.6 μM/min和3.3 μM/min(圖3b)。由于RBS在水介質中的穩定性有限,即使小心地保護不受光,在RBS溶液中也很容易檢測到NO。在RBS-NP溶液中,初始NO水平明顯降低,表明RBS在疏水環境中籠化提高了RBS的穩定性。因此,RBS-NP可作為一種光控釋放NO的平臺而不會對籠狀結構造成損傷。
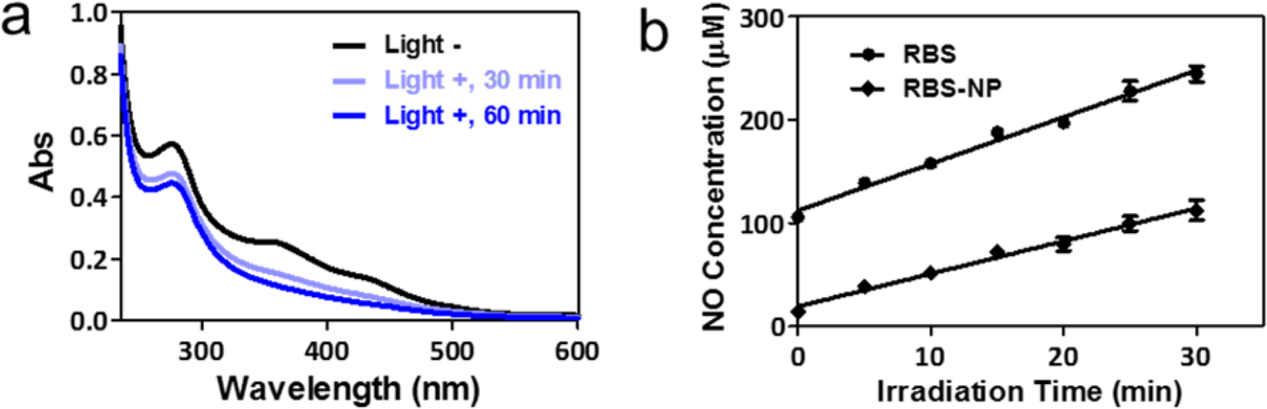
圖3. (a) RBS-NP在光照前后的吸收光譜;(b)由RBS和RBS- np產生的NO濃度隨光照時間的變化曲線。
因為Fe - S團簇被籠化而不是被脫鐵蛋白外殼吸收,所以脫鐵蛋白材料的細胞內化不會受到Fe - S團簇的影響。作者對兩種**細胞系HeLa和MCF-7進行了體外光活性和毒性實驗。RBS-NP 16 h的細胞培養,用PBS洗滌,DCF-FM DA染色,白光LED曝光(12 mW /cm2) 30分鐘。在熒光顯微鏡下,RBS-NP處理的HeLa細胞的亮綠色圖像反映了有效的細胞攝取和光誘導的NO釋放(圖4a)。經過RBS或RBS-NP處理的MCF-7細胞和光處理后,其熒光強度明顯降低,可能是由于細胞內清除反應的存在縮短了NO壽命。為了研究細胞反應是否與細胞內氧化應激水平有關,我們使用熒光反應氧物種(ROS)探針DCFH-DA對H2O2處理的HeLa和MCF7細胞進行了成像,無論光照與否。光暴露不影響ROS水平。與HeLa細胞不同,MCF-7細胞在H2O2的作用下表現出ROS水平的抑制,而HeLa細胞則表現出細胞內ROS水平的升高。因此,氧化應激反應似乎存在細胞類型依賴機制。
MTT法測定了RBS和RBS-NP在黑暗條件下的細胞毒性。在0.5、1、2、3、4、6、8和10 μg/mL鐵濃度下,分別用RBS或RBS-NP處理HeLa和MCF細胞48 h,然后進行MTT實驗。在HeLa細胞中,RBS和RBS-NP的IC50值分別為3.7和5.4 μg/mL Fe(圖4b)。在MCF-7細胞中,也觀察到相對于RBS,暗色RBS-NP的細胞毒性降低。對于正常細胞,RBS和RBS-NP在人肝細胞QSG細胞上表現出類似的鐵濃度依賴性的存活率,IC50值增加到約10 μg/mL。此外,研究了NO釋放對HeLa和MCF-7細胞的光毒性作用。細胞治療與RBS或RBS-NP鐵劑量為1.0μg/mL 16 h,然后被白光LED曝光(12 mW/cm2)不同分鐘(0、5、10、15、20、25、30分鐘),與PBS再孵育24小時。如圖4c所示,用脫鐵蛋白處理HeLa細胞,或光處理,或暗處理RBS,或暗處理RBS-NP均不影響細胞活力。RBS或RBS-NP處理過的MCF-7細胞表現出更高的光照耐受性,這是由于上述MCF-7細胞中細胞內氧化應激的抑制。細胞以不同的途徑吸收RBS和RBS-NP。小尺寸疏水的RBS具有細胞膜通透性,而RBS-NP只能通過受體介導的內吞作用內化,導致鐵攝取速率的差異。HeLa和MCF細胞治療由RBS和在同一初始RBS-NP鐵濃度(3μg/mL)在無血清培養基遠離光1或2 h。對于HeLa細胞,在孵育后1 h和2 h, RBS-NP處理導致鐵的攝入量分別比RBS多14和5.3%;對于MCF-7細胞,在1和2小時內,RBS-NP處理比RBS分別增加了18和12%的鐵攝入量。因此,RBS的吸收可以通過籠狀策略增強。
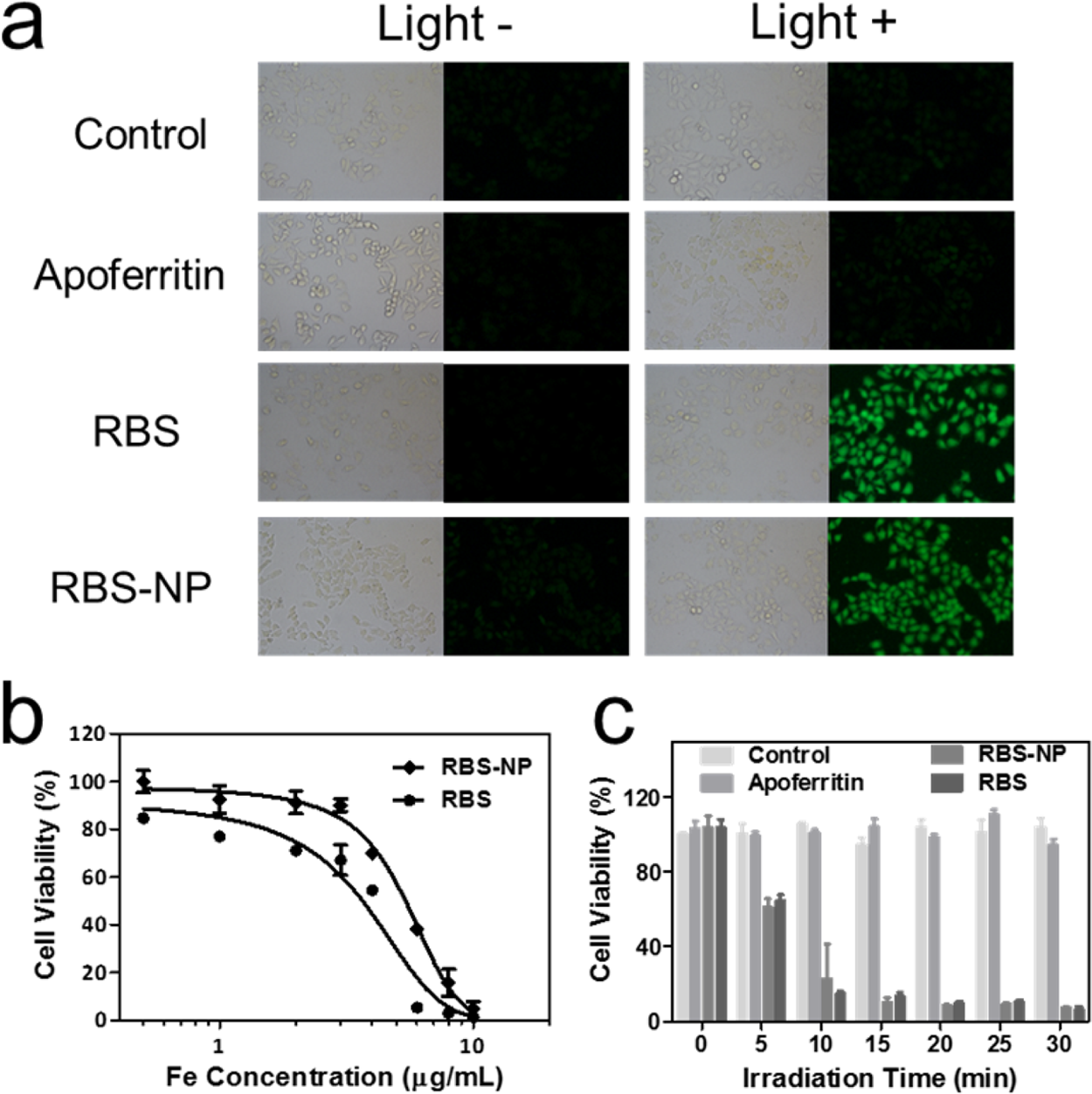
圖4。(a)使用DCF-FM DA作為NO探針,在光照前和光照后使用RBS或RBS-NP處理的HeLa細胞的熒光圖像;(b)不同Fe濃度下RBS和RBS- np處理HeLa細胞的MTT分析;(c)不同照射時間下,脫鐵蛋白或RBS或RBS- np處理的HeLa細胞的MTT分析。
結論
作者在pH 7.4下將光活性Fe-S團簇加入脫鐵蛋白的籠子內部,避免了傳統的蛋白質分解重組過程。體積龐大的RBS復合物以42%的負載效率封裝。疏水蛋白籠對水敏感的RBS具有顯著的穩定性,納米級復合材料可保存在PBS緩沖液中,且至少有2個月的保質期。RBS復合材料的高效細胞攝取和光控NO釋放特性允許細胞類型依賴性的藥物應用于基于NO的治療。
參考文獻
Xiao Li, Yajie Zhang, Jian Sun, Weijian Chen, Xuewei Wang, Fenli Shao, Yuyu Zhu, Fude Feng* , Yang Sun*,Protein Nanocage-Based Photo-Controlled Nitric Oxide Releasing Platform, ACS Appl. Mater. Interfaces, 2017, 9, 19519?19524. DOI: 10.1021/acsami.7b03962. https://pubs.acs.org/doi/10.1021/acsami.7b03962
產品提供
| 序號 | 新聞標題 | 瀏覽次數 | 作者 | 發布時間 |
|---|---|---|---|---|
| 1 | 瑞禧定制-功能化1,2,4,5-四嗪Cis-[Pt-1,3-Propanediamine]-2-Me-Tetrazine/IC-MethylTetrazine | 716 | 瑞禧生物 | 2022-11-09 |
| 2 | 科研-四嗪Py-Tetrazine-PEG1-Alkyne/Py-PEG1-Alkyne/Pyrimidine-Tetrazine-PEG1-Alkyne | 737 | 瑞禧生物 | 2022-11-09 |
| 3 | 胺基與NHS活性酯反應PEG之Azido-PEG7-amine/1333154-77-0瑞禧生物 | 1475 | 瑞禧生物 | 2023-01-03 |
| 4 | 瑞禧2023更新 Azido-PEG8-acid疊氮八聚乙二醇羧酸 | 640 | 瑞禧生物 | 2023-01-03 |
| 5 | 嵌段共聚物4 arm-PEG-TK-NH2 /NHS/MAL | 728 | 瑞禧生物 | 2022-12-08 |
| 6 | 活性氧敏感聚合物TK-PPE 酮縮硫醇-聚磷酸酯 PPE-TK | 773 | 瑞禧生物 | 2022-12-08 |
| 7 | 功能化腙鍵響應性磷脂 DSPE-Hyd-PEG-Alkyne/CHO/cRGD 醛基/多肽 | 771 | 瑞禧生物 | 2022-12-08 |


 400-115-0588
400-115-0588 在線咨詢
在線咨詢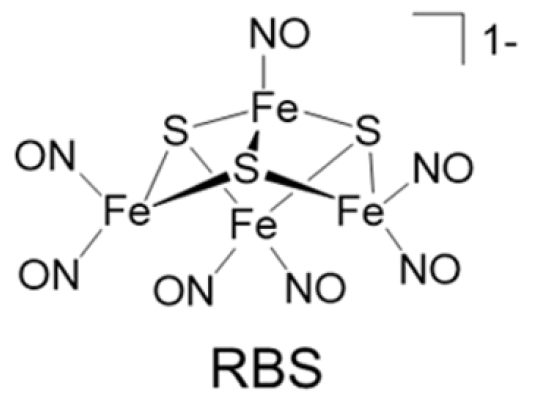








 庫存查詢
庫存查詢