- 029-86354885
- 18392009562
內容提要
CO不僅可以選擇性地殺傷**細胞,而且由于缺乏主動的**靶向能力,抗**效果有限。將線粒體靶向的線粒體內微環境響應前藥(FeCO-TPP)封裝在介孔二氧化硅納米顆粒內,再通過靜電分步組裝,將其包覆在透明質酸上,構建一種新型智能納米藥物,并以分步分解的方式實現**組織細胞/線粒體靶向的CO多階段控制釋放。CO的多階段靶向控釋釋放包括(i)被動靶向**組織的納米藥物釋放,(ii)主動靶向**細胞的納米藥物釋放,(iii)酸響應性前藥釋放,(iv)線粒體靶向性前藥釋放以及(v)ROS響應性CO釋放。該納米藥物有效地增強了CO在體內外治療癌癥的有效性和安全性。本文提出的多階段組裝/解組裝策略為CO的靶向治療打開了一個新的窗口。
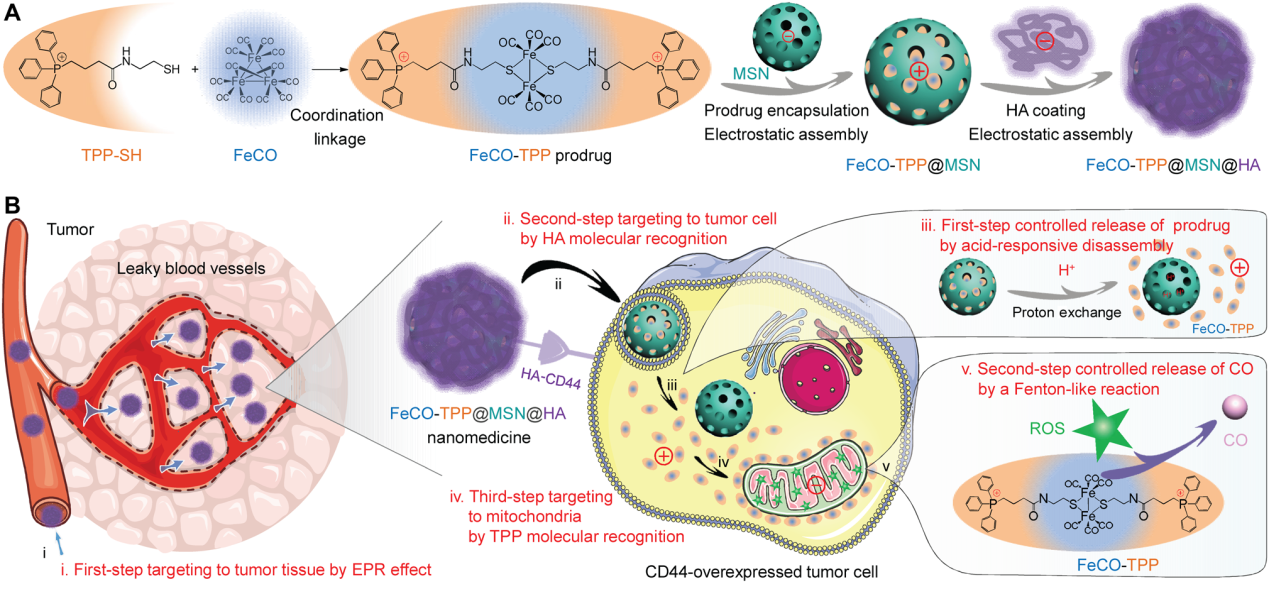
前言
高血藥濃度和低瘤內積累分別會導致CO中毒風險和限制CO治療療效。目前CO治療的兩種主要給藥途徑是直接吸入CO氣體和吸收CO前藥。直接吸入CO氣體很難控制CO的攝入量,而現有CO前藥缺乏**靶向能力。兩種CO給藥途徑都有較高的CO中毒風險。因此,CO的靶向釋放和控釋對于提高CO治療的有效性和生物安全性至關重要。基于多功能納米材料的智能納米藥物靶向遞送CO前藥和瘤內控釋CO是一種重要策略。但是,已被開發的**靶向遞送和控制釋放CO的納米藥物只能將CO遞送到溶酶體或細胞質中,而不是線粒體。線粒體是CO發揮其生理功能的靶點,其中CO通過與氧氣激烈競爭結合細胞色素c氧化酶以損害**細胞線粒體生物能,從而抑制線粒體呼吸,導致**細胞凋亡。CO前藥順序靶向遞送到**組織、細胞、線粒體可能會獲得理想的CO治療效果。作者提出了一種多階段靶向釋放和控釋策略,構建了一種多功能智能納米藥物(FeCO-TPP@MSN@HA),有序實現納米藥物靶向**組織(第一步靶向)、靶向**細胞(第二步靶向)、一種新的CO前體藥物的納米藥物酸響應釋放(第一步控釋),前體藥物的線粒體靶向釋放(第三步靶向),以及CO的線粒體內活性氧(ROS)響應釋放(第二步控釋)。本工作選擇帶負電荷的介孔二氧化硅納米顆粒(MSN)作為生物相容性載體,通過靜電組裝有效地負載帶正電荷的線粒體靶向/線粒體微環境響應藥物前體FeCO-TPP前藥,實現FeCO-TPP前藥的酸響應降解和釋放,通過靜電組裝將透明質酸(HA)進一步包覆在小型單分散二氧化硅(FeCO-TPP@MSN@ HA)表面,既可以通過增強通透性和保留(EPR)效應實現被動靶向**,也可以主動靶向過表達CD44的**細胞,通過分段靶向釋放和控釋,以逐步解組裝的方式實現高效和安全的線粒體靶向CO治療癌癥的體內外,能夠將CO遞送到癌細胞的線粒體,顯示出癌癥治療的最大結果。
結果與討論
FeCO-TPP前藥和FeCO-TPP@MSN@HA的關鍵是既能以靶向的方式積累到線粒體中,又能以響應的方式在線粒體中釋放CO。帶正電荷的TPP陽離子由于其靜電和親脂性吸引線粒體膜,是一種很好的線粒體靶向分子。此外,金屬羰基化合物能夠通過類Fenton反應,ROS響應分解為CO。作者將TPP衍生物[3-羧基丙基三苯基溴化膦(TPP-COOH)]與金屬羰基化合物(FeCO)偶聯,合成了前藥FeCO-TPP。為了保護FeCO-TPP前藥并將其運送到**細胞中進行后續線粒體靶向,作者利用帶負電荷的MSN包覆帶正電荷的FeCO-TPP,利用EPR效應進行**靶向傳遞,然后靜電組裝包覆一層HA (CD44的受體)來識別過表達CD44蛋白的**細胞。所合成的單分散二氧化硅具有均勻的粒徑(約70 nm)、良好的分散性和高負的表面電位,有利于前藥負載和HA包覆。從圖1的D和E中可以發現,在單分散二氧化硅表面覆蓋了一層較薄的低對比度HA (約15 nm)。SEM圖像(圖1F)和DLS數據(圖1I)顯示,合成的FeCO-TPP@MSN@HA納米藥物保持了良好的分散性,由于HA涂層,其水化直徑略有增加(圖1F和1I)。FeCO-TPP@MSN的高正電勢使其易于靜電組裝,導致HA涂層使合成的FeCO-TPP@MSN@HA納米藥物的表面電位接近中性,并防止FeCO- TPP前藥和HA涂層在水溶液中高穩定性的泄漏)。
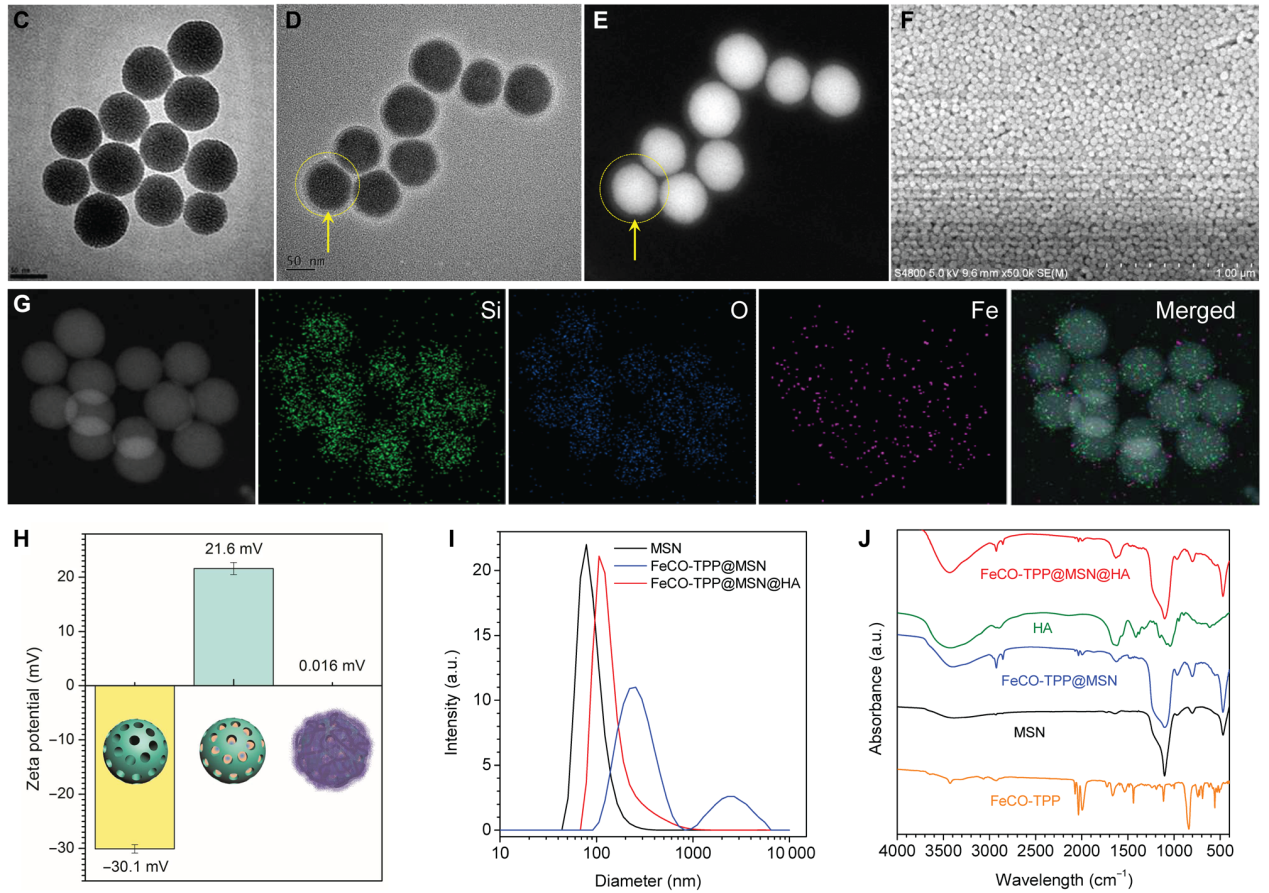
圖1. (C) 單分散二氧化硅的透射電鏡(TEM)圖像。FeCO-TPP@MSN@HA的TEM (D),高角度環形暗場(HADDF) (E),掃描電子顯微鏡(SEM) (F)和元素映射(G)。MSN,FeCO-TPP@MSN和FeCO-TPP@MSN@HA的Zeta勢(H),動態光散射(DLS)粒徑分布(I)和FTIR光譜(J)。
FeCO-TPP@MSN@HA能夠在到達**部位后識別/粘附到**細胞上,然后在被溶酶體吞入過程中脫去HA。為了證實這一順序過程,包括靶向**組織的納米藥物遞送,靶向**細胞的納米藥物遞送,對酸敏感的前藥釋放,靶向線粒體的前藥遞送,首先在體外模擬條件下研究FeCO-TPP@MSN的酸/ ROS響應釋放行為。FeCO-TPP@MSN在pH 7.4的PBS溶液中相當穩定,但在pH 6.8的微酸溶液中,FeCO-TPP前藥的釋放急劇,較高的酸度導致前藥釋放更快。這種酸響應行為來自于與帶正電荷的FeCO-TPP前藥物的質子交換(圖2A)。MSN表面的許多硅醇基團(Si─OH)可以電離成硅酸鹽(Si─O?)吸附FeCO-TPP+,也可以在酸性條件下質子化脫附/釋放FeCO-TPP+。作者進一步研究了不同濃度·OH下釋放的FeCO-TPP前藥對ROS的響應性CO釋放行為以模擬線粒體富集ROS的微環境。在·OH存在的情況下,FeCO-TPP由于·OH的強烈氧化而分解為CO(圖2B)。根據**的Warburg效應,·OH濃度越高,CO釋放越快,對惡性**細胞的影響越強烈。
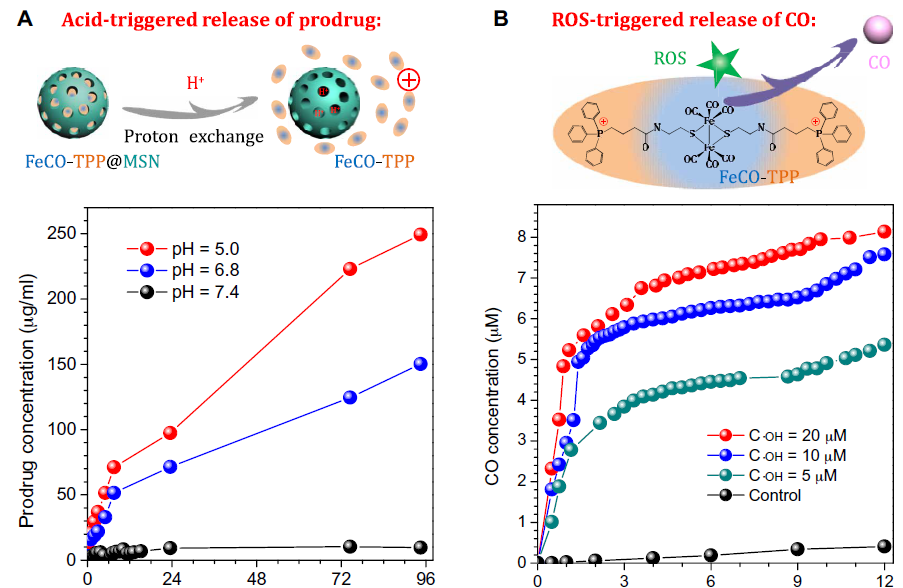
圖2. FeCO-TPP@MSN納米藥物在體外模擬條件下的酸響應性前藥釋放曲線(A)和FeCO-TPP前藥在不同·OH濃度下的線粒體內ROS響應性CO釋放曲線(B)。
利用激光共聚焦對體外連續多階段靶向釋放和細胞控釋過程進行了評價。首先,分別用紅羅丹明B異硫氰酸酯(RITC)和8-巰基喹啉(QL)標記MSN載體和FeCO-TPP前藥構建FeCO-TPP@MSN@HA納米藥物進行熒光示蹤。HeLa和4T1細胞在相同條件下與其他癌細胞相比,可以更有效地吞入FeCO-TPP@MSN@HA納米藥物,因為它們的CD44顯著過表達(圖3A)。同時,納米藥物很少被正常的MCF-10A和人類胚胎腎(HEK) 293T內吞,因為CD44正常低表達的細胞,因此該納米藥物可以專一靶向CD44過表達的癌細胞,并進行靶向給藥。作者選擇具有最高識別性的HeLa細胞進行進一步靶向釋放和控釋階段的研究。HeLa細胞內吞FeCO-TPP@MSN@HA后,主要位于溶酶體(圖3B),主要體現在綠色和紅色合并成黃色。藍色逐漸出現,表明FeCO-TPP前藥從納米藥物在溶酶體的酸性環境中的持續釋放。為了追蹤前藥在線粒體內的靶向性,我們在與納米藥物共孵卵后,用綠色MitoTracker染料對HeLa細胞線粒體進行染色。將MSN載體和FeCO-TPP前藥分別用紅色RITC和藍色QL標記,構建FeCO-TPP@MSN@HA納米藥物進行熒光示蹤。為了便于區分藥物釋放監測的顏色,我們將共焦圖像中的線粒體和MSN通道分別設置為紅色和綠色。紅色和藍色的出現產生了紫色,代表前藥在線粒體內的積累。紫色的增加代表線粒體,對釋放的FeCO-TPP前藥的攝取(圖3C)。隨著前藥在溶酶體中從納米藥物釋放,前藥通過TPP分子識別逐漸積累到線粒體中,表現為線粒體靶向前藥傳遞階段。FeCO-TPP前藥的線粒體靶向能力歸功于其與線粒體膜的靜電和親脂性吸引,為線粒體響應性CO釋放提供了機會。熒光COP-1 (CO probe -1)探針用于檢測細胞內CO釋放。隨著孵育時間的增加,綠色熒光強度的增強反映了CO在HeLa細胞中釋放的增加(圖3D)當FeCO-TPP前藥到達HeLa細胞線粒體時,線粒體內ROS觸發了CO的釋放,這是由于其ROS響應行為。以上四個方面的研究結果證實了多階段順序靶向釋放和控釋過程。
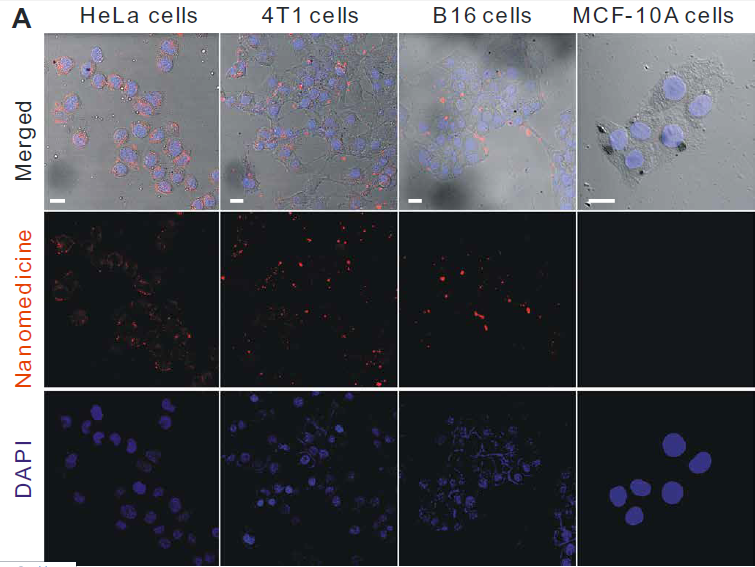
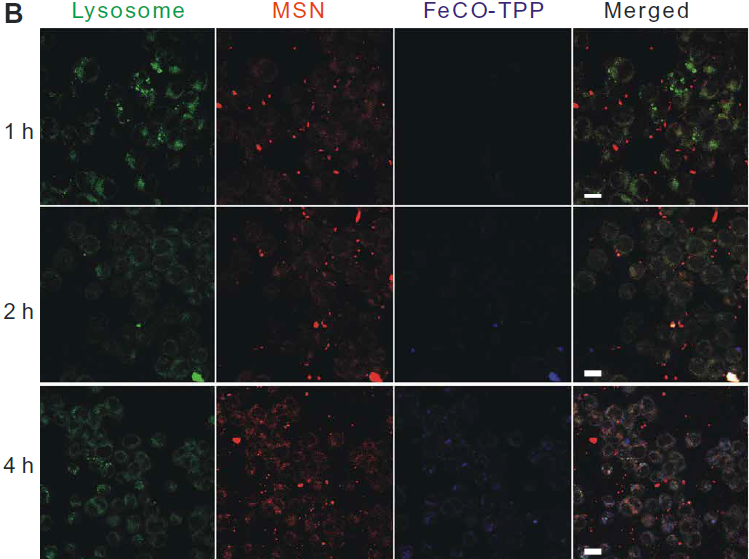
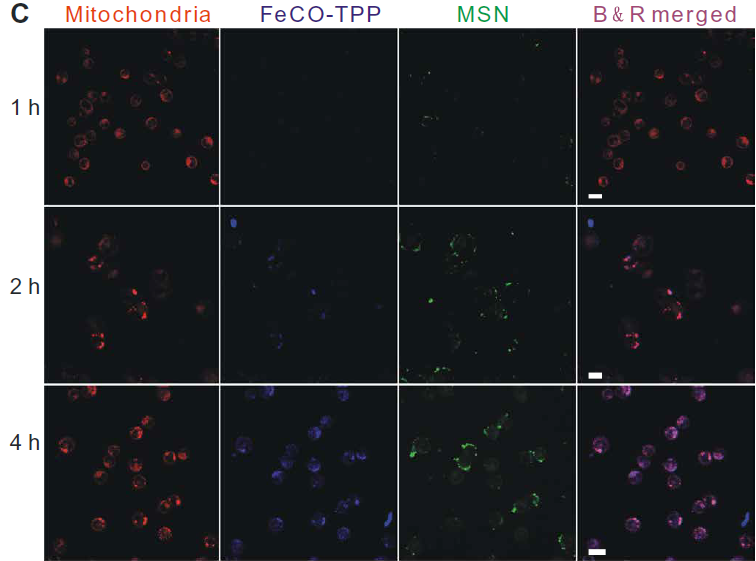
圖3所示。 (A) HeLa、4T1、B16和MCF-10A細胞與FeCO-TPP@MSN-RITC@HA孵育4小時,并用4,6-二氨基-2-苯吲哚(DAPI)染色,MSN載體用紅色的RITC標記,然后用于構建FeCO-TPP@MSNRITC@HA納米藥物。(B) FeCO-TPP@MSN@HA納米藥物的溶酶體內酸響應前藥釋放行為,LysoTracker染色(綠色),FeCO-TPP前藥用藍色QL(8-巰基喹啉)標記。(C) FeCO-TPP@MSN@HA納米藥物的線粒體靶向前藥物傳遞行為,MitoTracker(紅色)染色。
選擇兩個**細胞系(HeLa和4T1)和兩個正常細胞系(HEK-293T和MCF-10A)研究FeCO-TPP@MSN@HA納米藥物的體外抗癌性能。從圖4 (A到D), FeCO-TPP,FeCO-TPP@MSN和FeCO-TPP@MSN@HA對兩種癌細胞均表現出劑量和時間依賴性的細胞毒性行為,但在0-100 mg/ml濃度范圍內,盡管孵育時間較長,對正常細胞的毒性不顯著。與FeCO-TPP和FeCO-TPP@MSN相比,FeCO-TPP@MSN@HA納米藥物在相同的孵育濃度和時間下對癌細胞的損傷最大,這可能與靶向給藥有關。從圖4 (A和B), FeCO-TPP@MSN@HA對HeLa和4T1細胞的ED50分別為82.6和41.5 mg/ml)。作者還使用CORM-3作為CO供體來測量ED50值在HeLa和4T1細胞上CO的濃度分別為147.3和110.9 mM。盡管CO持續釋放,FeCO- TPP@MSN@HA仍容易快速達到足夠高的CO濃度殺滅**細胞。FeCO- TPP@MSN@HA的細胞毒性隨著孵育時間的延長而顯著增加(圖4,A和B),甚至高于游離前藥FeCO- TPP。這可能是由于HA介導的靶向抑制正常細胞對FeCO- TPP@MSN@HA納米藥物的攝取和/或CO的保護作用。作者還從細胞能量代謝的角度研究了納米藥物的癌癥選擇性機制。從圖4 (E H), MSN幾乎沒有影響腺苷5 '三磷酸腺苷(ATP)含量的HeLa和MCF-10A細胞,而FeCO-TPP FeCO-TPP@MSN,和FeCO-TPP@MSN@HA顯著抑制ATP的HeLa細胞水平按照線粒體數量減少(圖4,I和J),導致抗癌的結果。此外,細胞內乳酸水平FeCO-TPP@MSN@HA治療后明顯增強,表明在糖酵解過程中有氧呼吸的HeLa細胞被CO抑制,而無氧呼吸和乳酸消耗被激活,導致HeLa細胞ATP水平下降。雖然FeCO-TPP和FeCO-TPP@MSN也抑制了MCF-10A細胞的ATP水平(圖4E),但線粒體數量并沒有減少(圖4,K和L),這可能是因為從其泄漏的帶正電荷的FeCO-TPP和FeCO-TPP@MSN和/或CO容易被內吞噬,從而在一定程度上影響線粒體功能,而中性的FeCO-TPP@MSN@HA不泄漏CO則不會。FeCO-TPP@MSN@HA對MCF-10A細胞的ATP水平和線粒體數量均無影響(圖4,E, K和L),因為它具有識別CD44的能力,反映了對正常細胞的低細胞毒性。基礎呼吸情況與ATP產生情況相似(圖4F),但經FeCO-TPP@MSN和FeCO-TPP@MSN @HA處理的MCF-10A細胞的最大呼吸和質子泄漏仍保持不變(圖4G),進一步說明了保護作用。綜上,FeCO-TPP@MSN@HA納米藥物損害了癌細胞線粒體功能,但保護了正常細胞的線粒體,維持正常的能量代謝。
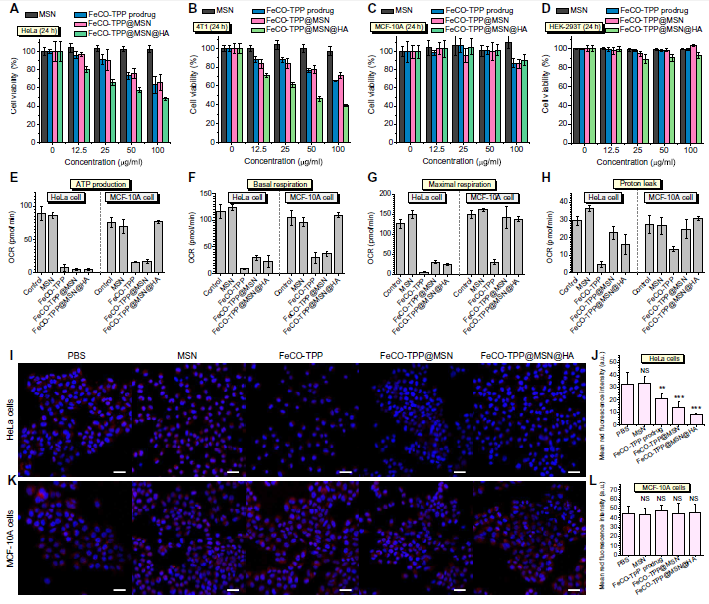
圖4. (A到D) FeCO-TPP@MSN@HA納米藥物對癌癥(HeLa和4T1細胞)和正常(MCF-10A和HEK-293T細胞)模型細胞系的細胞毒性。(E to H)通過ATP產生(E)、基礎呼吸(F)、最大呼吸(G)和質子泄漏(H)評價細胞能量代謝。(I和K)處理后的HeLa和MCF-10A細胞共聚焦圖像,細胞核和線粒體分別染成藍色和紅色。(J)和(L)分別為(I)和(K)中紅色熒光強度的定量。平均值和誤差用平均值±SD表示。P值采用雙尾Student 's t檢驗計算(**P < 0.01, ***P < 0.001;NS,差異無統計學意義)。比例尺(I和K), 20 mm。OCR,耗氧量
在靜脈注射FeCO-TPP@MSN@HA納米藥物用于**治療之前,首先靜脈注射FeCO-TPP@MSN@HA后檢查其血液安全性與PBS對照、MSN載體、FeCO-TPP前藥和FeCO-TPP@MSN進行比較,其中包含等量的MSN和FeCO-TPP。采集不同時間點(注射后1、7、20天)的血樣進行測定。與PBS對照相比,相同劑量的MSN載體、FeCO-TPP前藥和FeCO-TPP@MSN, FeCO-TPP@MSN@HA在注射后20天內(治療時間相同)未對肝臟和腎功能造成重大損害。此外,白細胞、紅細胞、血紅蛋白、紅細胞壓積、平均紅細胞體積、平均紅細胞血紅蛋白、平均紅細胞血紅蛋白濃度、紅細胞體積分布寬度等標準血液學指標水平無明顯差異,表明FeCO-TPP@MSN@HA具有較高的血液相容性。使用FeCO-TPP@MSN@HA納米藥物進行體內治療,分別使用攜帶B16和4T1**的小鼠模型。首先,研究了**靶向傳遞行為。從Fig. 5A的體內熒光成像結果可以發現,游離的FeCO-TPP快速排出,瘤內積累很少,而MSN和FeCO- TPP@MSN@HA均能有效積累到**中。從CD31染色(綠色血管)的**切片顯示,FeCO- TPP@MSN@HA納米藥物溢出(圖5B),并與封裝的FeCO- tpp前藥一起滲透到**細胞中(圖5C),表明所研究的**的EPR效應和納米藥物對**的有效靶向傳遞。B16荷瘤**小鼠隨機分為5組(n = 5)靜脈注射PBS控制, MSN載體), FeCO-TPP前體藥物, FeCO-TPP@MSN和FeCO-TPP@MSN@HA,分別等摩爾濃度的MSN或FeCO-TPP。從圖5 (D - F)的治療結果來看,MSN載體對B16荷瘤小鼠的**生長沒有影響。相比之下,FeCO-TPP在治療20天后雖無**靶向能力,但對**生長有輕微抑制作用,而FeCO-TPP@MSN由于其被動作用,在一定程度上增強了**治療效果目標的行為。此外,FeCO-TPP@MSN@HA可以進一步提高**治療療效由于其被動和主動目標概要文件(圖5 D, F)。的H&E染色**切片進一步證實FeCO-TPP@MSN@HA納米藥物可以消除**細胞最有效而FeCO-TPP和FeCO-TPP@MSN(圖5 g)。各治療組對心、肝、脾、肺、腎等主要臟器均未造成明顯損傷,說明治療劑量時生物相容性良好。用FeCO-TPP@MSN@HA納米藥物治療的小鼠沒有明顯的體重減輕,這表明健康狀況良好。
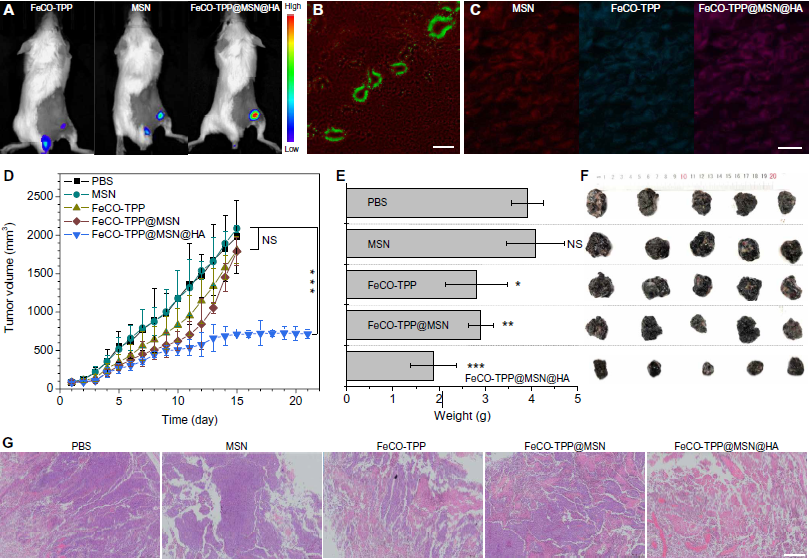
圖5. **靶向的熒光圖像:FeCO-TPP**小鼠靜脈注射的藥物前體,MSN的載體,FeCO-TPP@MSN@HA(A)。FeCO-TPP@MSN@HA治療的**切片CD31染色(B和C),綠色,紅色,和藍色代表血管,MSN,和FeCO-TPP。納米藥物治療B16**的結果:**體積隨時間變化(D),治療20天后**重量比較(E),小鼠體重隨時間變化(F), H&E染色對治療后**的組織學分析(G)。平均值和誤差用平均值±SD表示。通過Tukey事后檢驗的單因素方差分析(ANOVA)計算P值,以校正多重比較(*P < 0.05, **P < 0.005, ***P < 0.0005)。比例尺200mm
序號
新聞標題
瀏覽次數
作者
發布時間
1
瑞禧定制-功能化1,2,4,5-四嗪Cis-[Pt-1,3-Propanediamine]-2-Me-Tetrazine/IC-MethylTetrazine
714
瑞禧生物
2022-11-09
2
科研-四嗪Py-Tetrazine-PEG1-Alkyne/Py-PEG1-Alkyne/Pyrimidine-Tetrazine-PEG1-Alkyne
733
瑞禧生物
2022-11-09
3
胺基與NHS活性酯反應PEG之Azido-PEG7-amine/1333154-77-0瑞禧生物
1471
瑞禧生物
2023-01-03
4
瑞禧2023更新 Azido-PEG8-acid疊氮八聚乙二醇羧酸
635
瑞禧生物
2023-01-03
5
嵌段共聚物4 arm-PEG-TK-NH2 /NHS/MAL
723
瑞禧生物
2022-12-08
6
活性氧敏感聚合物TK-PPE 酮縮硫醇-聚磷酸酯 PPE-TK
770
瑞禧生物
2022-12-08
7
功能化腙鍵響應性磷脂 DSPE-Hyd-PEG-Alkyne/CHO/cRGD 醛基/多肽
767
瑞禧生物
2022-12-08


 400-115-0588
400-115-0588 在線咨詢
在線咨詢







 庫存查詢
庫存查詢