- 029-86354885
- 18392009562

內容提要
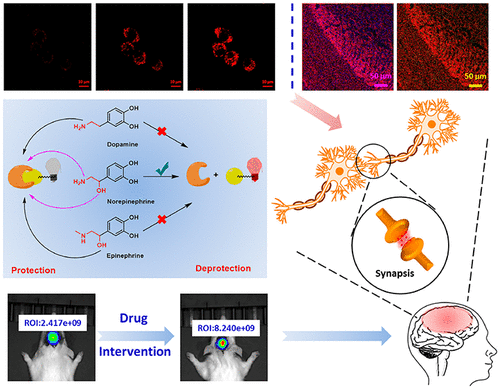
近年來,社會壓力的增加和其他因素導致抑郁癥患者人數的激增。目前,普遍認為嚴重抑郁癥的內因是腦組織去甲腎上腺素(NE)水平降低。去甲腎上腺素與另外兩種兒茶酚胺神經遞質——腎上腺素(EP)和多巴胺(DA)在結構和化學性質上非常相似。這三種神經遞質在生物系統中通過酶反應依次合成。因此,設計去甲腎上腺素特異性熒光探針具有一定的挑戰性。作者采用了“保護-去保護”策略:長發射波長含水溶性磺酸的花菁被硫代碳酯保護,去甲腎上腺素β-羥基乙基胺通過親核取代和分子內親核環化反應釋放熒光團。該策略實現了去甲腎上腺素的特異性紅色熒光檢測,以及鉀離子刺激下去甲腎上腺素神經信號轉導的成像。更重要的是,作者首次實現抗抑郁藥物刺激大鼠大腦去甲腎上腺素水平的實時熒光成像。
前言
隨著社會壓力的增加,抑郁癥狀的患者數量猛增。抑郁癥已成為全球殘疾的主要原因和全球疾病負擔的主要貢獻者。抑郁癥與大腦中去甲腎上腺素(NE)水平的降低密切相關。去甲腎上腺素是單胺類兒茶酚胺神經遞質合成的中心物質,在苯乙醇胺N-甲基轉移酶(PMNT)的作用下,多巴胺(DA)的酶促反應,再產生腎上腺素(EP)。這三種單胺類神經遞質的結構和性質相似,都是通過酶反應先后合成的。設計能對去甲腎上腺素產生特異性反應的熒光探針是一項極其困難的任務。傳統的神經遞質檢測方法主要依靠電化學分析和質譜分析,但在體內原位檢測時往往存在一定的局限性。目前,熒光法檢測和標記去甲腎上腺素主要包括以下幾個方面。Kleinfeld團隊報告了基于細胞的神經遞質熒光報告器;CNiFERs用于神經信號傳導過程中NE或DA細胞外濃度的變化的熒光成像;Sames報告了使用神經遞質熒光染料FFN270對神經信號傳導過程中NE的釋放進行成像;Li報道NE和GPCR的特異性結合被用來調節與GPCR連接的cpEGFP脫質子過程,釋放增強的單通道熒光信號,實現特異性、高靈敏度以及實時監測;Glass小組利用有機小分子對神經遞質進行熒光檢測。基于去甲腎上腺素特異性反應的熒光探針檢測神經遞質含量和釋放標記物仍然是一個挑戰。作者利用花菁作為熒光團,延長去甲腎上腺素的發射波長,引入磺酸鹽,大大提高其水溶性,實現了水溶液中去甲腎上腺素的紅色熒光檢測,并成功標記細胞中的去甲腎上腺素囊泡,對高鉀離子刺激下去甲腎上腺素胞排過程進行了成像,實現抗抑郁藥氟西汀誘導體內去甲腎上腺素升高的原位成像,對抑郁癥藥物治療的研究和篩選具有一定的現實意義。
結果與討論
作者在體外研究了探針對去甲腎上腺素的紫外-可見和熒光響應。將5 mM NE加入含10 μM探針的2 mL PB (pH 5.0)中。如圖1a所示,體系在675和775 nm處的紫外吸收隨時間逐漸減小,而在550 nm處的紫外吸收則逐漸增加。因此,在加入NE后,體系的熒光強度在640 nm處逐漸增加,是只含探針的體系的14倍(圖1b)。反應后體系的光譜性質與花菁酮本身的光譜性質基本一致。與去甲腎上腺素相比,多巴胺和腎上腺素仍能誘導較少的熒光強度增強(圖1c)。作者還研究了其他神經遞質(5 mM),如5- HT,GABA和氨基酸(500 μM),如蘇氨酸,絲氨酸,賴氨酸,都沒有引起探針明顯的熒光變化。另外,100 μM半胱氨酸/10 μM同型半胱氨酸與類似的巰基乙胺和5 mM GSH,也沒有誘導顯著的熒光響應。本工作大大縮短了探針響應時間,在50 min內完成反應,最大限度地減少了氧化還原對去甲腎上腺素的損失。通過質譜證實了探針對去甲腎上腺素的特異性響應機制。
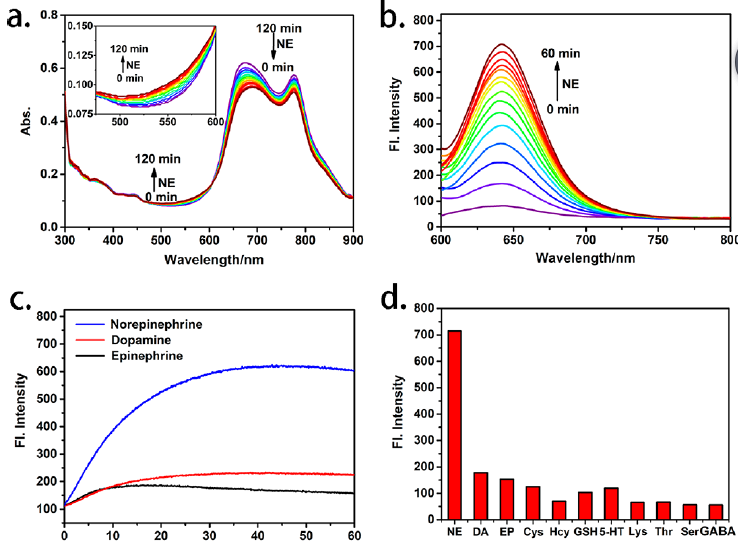

圖1. (a) 10 μM探針對5 mM NE在PB (pH 5.0)中的紫外-可見響應0 ~ 120分鐘。(b) 10 μM探針對5 mM NE在PB (pH 5.0)中的熒光響應0 ~ 60分鐘(λex= 550 nm)。(c)時間依賴10 μM探針5 mM NE、DA,和EP 0?60分鐘。(d) 10 μM探針在5 mM的選擇性神經遞質 (DA,EP,,NE,5-GABA)、谷胱甘肽,氨基酸500 μM(賴氨酸,蘇氨酸,絲氨酸), 100 μM Cys和10 μM Hcy。去甲腎上腺素響應機理示意圖
作者選擇了幾種細胞來標記內源性去甲腎上腺素。當20 μM探針與HeLa細胞和HepG-2細胞在37°C下培養40 min時,未觀察到明顯的熒光發射。PC12細胞可分泌富含去甲腎上腺素的囊泡并有胞吐作用。與PC12細胞在類似條件下培養后,可以觀察到明顯的紅色熒光發射,并隨時間的推移而增加(圖2)。該探針可以標記囊泡中的去甲腎上腺素去甲腎上腺素排出過程的顯像。

圖2. PC12細胞、HeLa細胞和HepG2細胞經20μM探針在紅色通道中培養5 ~ 40分鐘(λex = 561 nm, bar = 20μM)。
高濃度鉀刺激細胞產生的動作電位導致電壓依賴性鈣離子通道去極化,打開鈣離子通道。在電化學電位的驅動下,鈣離子從外部流入細胞,細胞質中鈣離子濃度的增加觸發了囊泡與細胞質膜的融合,可以刺激神經遞質的釋放。作者用高K+溶液刺激孵育探針標記的去甲腎上腺素囊泡的PC12細胞,細胞內的熒光點強度逐漸降低。但在相同條件下,用PBS(不含鉀離子)刺激細胞,紅色通道的熒光強度幾乎沒有變化(圖3)表明,K+濃度增加導致細胞胞飲,探針實現了去甲腎上腺素信號通路的可視化。

圖3. (a - e)高K+(100 μL)的PC12細胞在紅色通道(0?40 s), (f - j)含PBS的PC12細胞在紅色通道(0?40 s),(K)含PBS的PC12細胞在0?40 s (λex= 561 nm, bar = 20 μm)。
作為一種長波長的紅色熒光探針,我們將其用于腦組織的標記。對TH和DBH或DBH和PNMT進行雙重免疫標記是一種成功有效的方法。作者首先使用兔抗酪氨酸羥化酶多克隆抗體和抗多巴胺β-羥化酶,隨后使用山羊抗兔IgG/Cy3二抗混合物和山羊抗小鼠IgG/ALexa Fluor 35030分鐘,然后用探針(10 μM)染色120分鐘。對于PNMT和DBH雙標記實驗,切片用兔抗PNMT多克隆抗體和抗多巴胺β-羥化酶2 h后,加入山羊抗兔IgG/Cy3二抗混合物(和山羊抗小鼠IgG/ALexa Fluor 350 30分鐘,然后用探針(10 μM)染色120分鐘。如圖4所示,探針(b1, b2)和DBH-AF350 (c1,c2)的熒光發射區域有廣泛的重疊(e1, e2),表明探針對去甲腎上腺素能神經元具有特異性的標記能力。同時,通過DBH和PNMT的雙重免疫標記,仍然顯示探針特異性地標記去甲腎上腺素高于腎上腺素(圖5)。這種雙向檢測策略有力地證明了探針能夠在組織水平上有效地、特異性地標記去甲腎上腺素。

圖4。(a1, a2) cy3標記TH陽性區域的免疫熒光。(b1, b2)探針標記的腦組織。(c1, c2)免疫熒光AF350標記DBH陽性區域。(d1) a1和b1的合并圖像。(d2) a2和b2合并后的圖像。(e1) b1和c1的合并圖像。(e2) b2和c2合并圖像(Cy3:λex= 548 nm。AF350: λex= 405 nm。探針:λex= 561 nm。Bar = 200μm)。

圖5. (a1, a2) cy3標記PNMT陽性區域的免疫熒光。(b1, b2)探針標記的腦組織。(c1, c2)免疫熒光AF350標記DBH陽性區域。(d1) a1和b1的合并圖像。(d2) a2和b2合并后的圖像。(e1) b1和c1的合并圖像。(e2) b2和c2合并圖像(Cy3:λex= 548 nm。AF350:λex= 405 nm。探針:λex= 561 nm。Bar = 200μm)。
由于探針的波長較長,成像的穿透深度總是受到波長的限制,有效地補充了熒光成像的局限性,進行了活體熒光成像。在小鼠背部右側注射探針(20 μM),然后注射去甲腎上腺素200 μM)在同一區域注入。在小鼠背部另一側注射20 μM探針和與NE體積相同的PBS。如圖6所示,信號NE組的紅通道隨時間增加而增加,而對照組則無明顯變化。我們認為該探針可作為體內NE檢測的有效工具,在神經遞質和信號通路的定量分析方面具有良好的臨床應用前景。
氟西汀作為一種選擇性5 -羥色胺再攝取抑制劑,可以增強5 -羥色胺的神經傳遞,產生與氟西汀一樣的抗抑郁作用,它還可以增加下丘腦、皮質、皮質和前額葉皮質中的多巴胺和細胞外去甲腎上腺素水平,作者進行了氟西汀干預下去甲腎上腺素釋放顯像實驗。我們給大鼠腹腔注射氟西汀(10mg /kg),手術暴露大腦40 min后,將探針(200 μM)直接注入大腦成像。與老鼠同樣體積的生理鹽水腹腔內,老鼠用氟西汀治療大腦中去甲腎上腺素水平明顯高于對照組(圖7),為臨床抗抑郁藥物的篩選和療效評估提供新的研究手段。
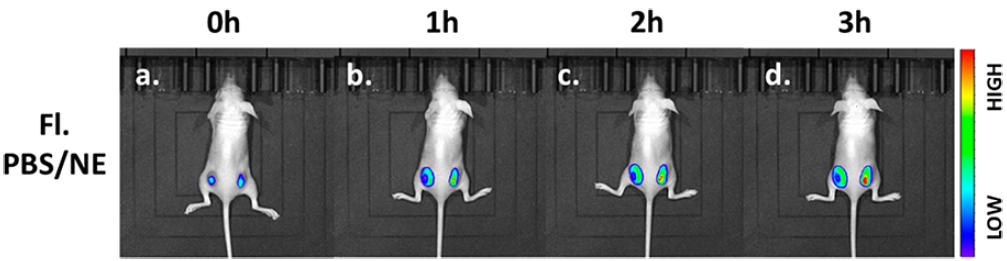
圖6. 注射PBS/NE (λex= 561 nm)的小鼠體內熒光成像。

圖7. (a?c)腹腔注射生理鹽水的大鼠體內成像。(d - f)腹腔注射氟西汀(10 mg/kg)的大鼠體內成像。(g)大鼠注射ROIs、生理鹽水和氟西汀的熒光強度(λex= 561 nm)。
結論
作者采用離開保護熒光團基團產生分子內PET效應,沒有熒光發射。隨后,利用NE獨特的氨基乙醇結構單元,通過級聯親核和離開反應,發生脫保護和熒光團釋放。利用長波長紅光熒光探針,我們通過細胞成像、切片成像和體內成像驗證了探針在復雜生物環境中對NE的特異性響應。作者應用該探針對高K+刺激下去甲腎上腺素胞飲信號通路進行熒光成像,并觀察到抗抑郁藥物對去甲腎上腺素干預的效果。
參考文獻
Na Zhou, Fangjun Huo, Yongkang Yue, and Caixia Yin*, Specific Fluorescent Probe Based on “Protect?Deprotect” To Visualize the Norepinephrine Signaling Pathway and Drug Intervention Tracers, J. Am. Chem. Soc., J. Am. Chem. Soc. 2020, 142, 17751?17755. DOI: 10.1021/jacs.0c08956. https://pubs-acs-org-s.z.library.sh.cn/doi/10.1021/jacs.0c08956
產品提供
| 序號 | 新聞標題 | 瀏覽次數 | 作者 | 發布時間 |
|---|---|---|---|---|
| 1 | 抗氧化小分子70831-56-0,菊苣酸Cichoric Acid,6537-80-0的制備過程 | 855 | 瑞禧生物 | 2023-03-30 |
| 2 | 活性氧ROS小分子Dapsone,cas:80-08-0,氨苯砜的制備過程-瑞禧科研 | 760 | 瑞禧生物 | 2023-03-30 |
| 3 | HBPS-N3,Azide-PEG-HBPS,疊氮化超支化聚苯乙烯高分子聚合物的制備過程 | 885 | 瑞禧生物 | 2023-03-17 |
| 4 | l-PS-PhN3,Azide疊氮Azido偶聯線性聚苯乙烯雙鏈的制備過程 | 805 | 瑞禧生物 | 2023-03-17 |
| 5 | N3-PS-N3,Azido-PS-Azido/Azide,雙疊氮官能團修飾聚苯乙烯的制備方法 | 769 | 瑞禧生物 | 2023-03-17 |
| 6 | PS-N3,Azido-PS,疊氮Azide修飾聚苯乙烯/高分子聚合物的制備過程 | 956 | 瑞禧生物 | 2023-03-17 |
| 7 | Azido-PEG2-t-Butylester/1271728-79-0,疊氮N3/ZAD修飾叔丁酯化合物的制備方法 | 790 | 瑞禧生物 | 2023-03-14 |


 400-115-0588
400-115-0588 在線咨詢
在線咨詢







 庫存查詢
庫存查詢